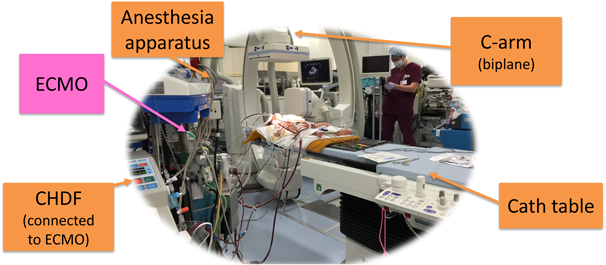
6症例全体のまとめ(Fig. 3)
今回の検討の対象とした6例の患者背景(年齢,性別,体重,基礎心疾患),およびそれぞれのCPS導入理由と施行したCI手技をTable 1に示す.施行時年齢は生後2か月~12歳3か月(中央値2歳2か月),男女比は4 : 2,体重は3.3~36 kg(中央値7.6±12.2 kg)であった.基礎心疾患は,心房頻拍,単心室,左心低形成症候群,肺動脈閉鎖兼心室中隔欠損・主要体肺側副血行,Williams症候群に伴う多発性末梢性肺動脈狭窄,両大血管右室起始であった.CPS導入理由は,開心術後人工心肺離脱不可2例,心外導管によるFontan型手術後鋳型気管支炎(plastic bronchitis)による呼吸不全1例,頻拍誘発性心筋症による循環不全1例,末梢肺動脈の高度狭窄による後負荷不適合のため術前から右室機能低下が著しく,主肺動脈からのハイブリッド治療のため選択的にCPS導入した例が2例であった.実施したCIの内訳は,高周波カテーテルアブレーション1例,体肺側副動脈コイル塞栓+左肺動脈ステント留置+Fontan心外導管開窓作成(Brockenbrough法による導管よび心房壁の穿通とそれに引き続くステント留置・拡大)1例,主要体肺側副動脈へのステント留置1例,両側肺動脈へのステント留置2例,末梢肺動脈バルーン拡張1例であった.
Table 1 Demographic data and reasons for and procedures of CI.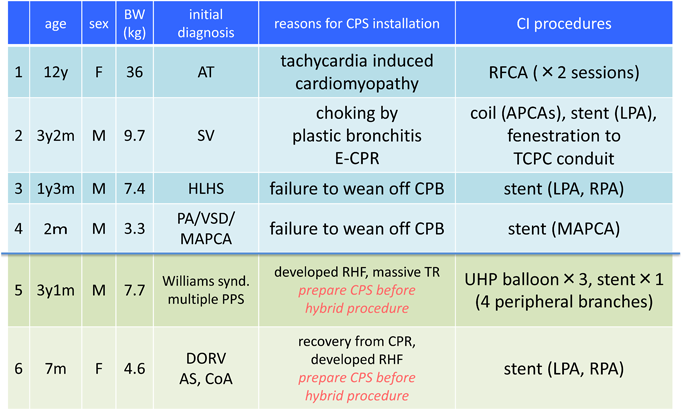 |
| APCAs: aortopulmonary collateral arteries, AS: aortic stenosis, AT: atrial tachycardia, BW; body weight, CI: catheter intervention, CoA: coarctation of aorta, CPB: cardiopulmonary bypass, CPS: cardiopulmonary support, DORV: double outlet right ventricle, ECMO: extracorporeal membrane oxygenation, E-CPR: ECMO-cardiopulmonary resuscitation, HLHS: hypoplastic left heart syndrome, LPA: left pulmonary artery, M, months, MAPCA: major aorto-pulmonary collateral artery, PA: pulmonary atresia, PPS: peripheral pulmonary artery stenosis, RHF: right heart failure, SV: single ventricle, TCPC: total cavo-pulmonary connection, TR: tricuspid regurgitation, UHP: ultra-high pressure, VSD: ventricular septal defect, Y, years |
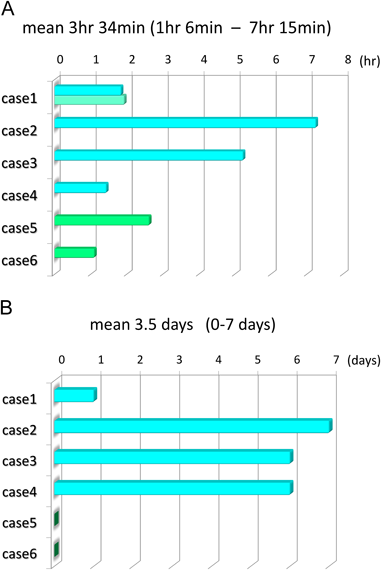
手技時間は平均3.5時間(1時間6分~7時間15分)であった(Fig. 4A).選択的にCPS導入した2例は手技終了後,心カテ室もしくは循環器集中治療室にて速やかにCPS離脱可能であり,CI前からCPS装着していた4例は手技成功後平均4.3日で全例離脱可能となった(Fig. 4B).
後述する症例6において,CI終了と同時にCPSを離脱した1例で出血が多く,翌日外科的な止血術を要し,その後縦隔洞炎を発症し洗浄および抗生剤投与により改善した.その他の症例においては手技に伴う合併症は認めなかった(Table 1).
代表的な症例の経過
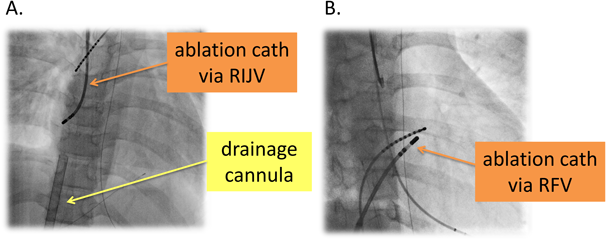
症例1では,2011年4月に薬物抵抗性の心房頻拍により頻拍誘発性心筋症を呈しショック状態に陥り,右大腿動静脈からのカニュレーションによるCPSが導入されていた.アブレーションは初回,右内頸静脈経由で三次元マッピングシステム(CARTO™ XP, Biosence Webster Inc)を併用して右心耳に存在する起源を標的として焼灼を開始した.しかし,複数箇所に起源を有する多巣性心房頻拍であることが判明し,心内電位で同定された起源にそれぞれ焼灼を試みるも発作の停止には至らなかった.そのため,3日後に再度,房室結節アブレーションおよびペースメーカー植え込みを行いCPS離脱に成功した(Fig. 5).
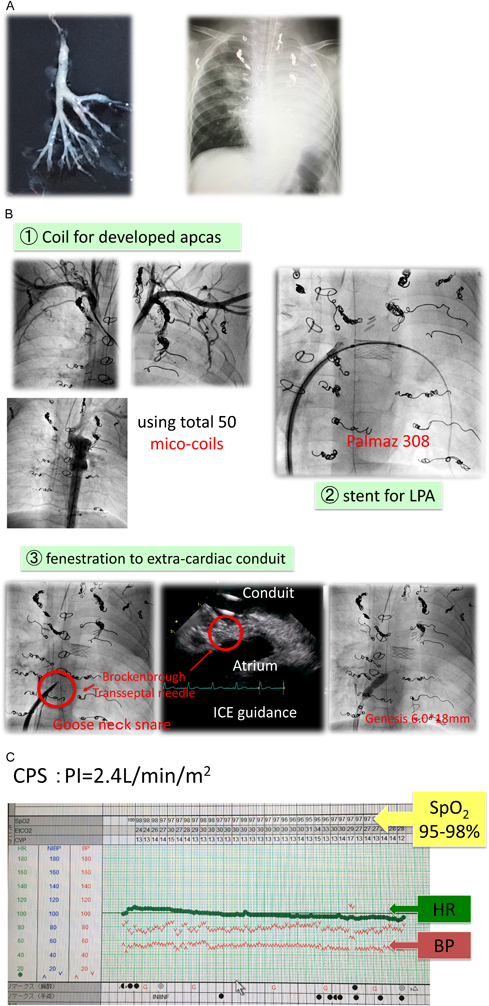
症例2は,単心室に対して1歳4か月時に18 mm人工血管による心外導管型Fontan型手術を施行後の男児.体肺側副血管残存により中心静脈圧高値,反復性喘鳴を呈しており,3歳2か月時に鋳型気管支炎(plastic bronchitis)を発症(Fig. 6A).入院加療中に窒息に陥り,右総頚動脈・内径静脈カニュレーションによるCPS導入を併用して蘇生が行われた.Fontan循環の破綻が急変の主因と考えられ,CPS導入6日後にCIに踏み切った.問題となる病変をできる限り克服することを目標として,以下の3種類の治療を連続して施行した(Fig. 6B):
- ①体肺側副動脈に対するコイル塞栓(着脱式・非着脱式マイクロコイル計50個使用)
- ②左肺動脈狭窄に対するステント留置(Palmaz 308を9 mmの血管拡張用バルーンにて留置拡大)
- ③心外導管開窓作成(Brockenbrough法による導管よび心房壁の穿通とそれに引き続くステント留置・拡大)
3種類の治療完遂のため手技時間は7時間15分に及んたが,末梢酸素飽和度,心拍数,血圧といったバイタルサインの変動はほとんどなく,安定した状態が保たれた(Fig. 6C).
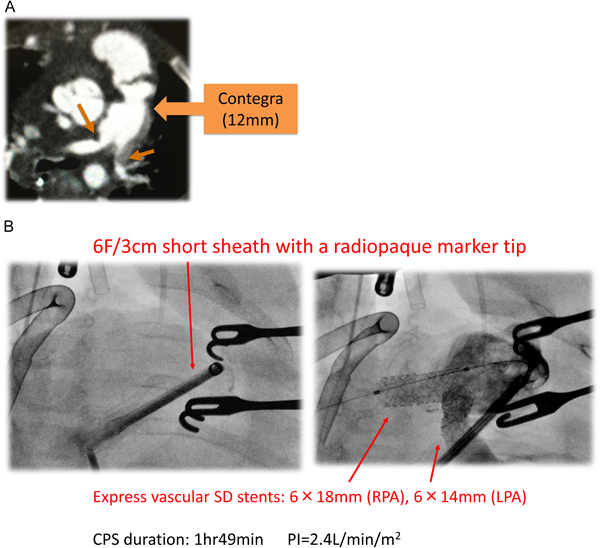
症例5および6では,CIのために選択的にCPSが導入された.いずれも両側末梢肺動脈の高度狭窄があり,重度の右室不全と三尖弁逆流があり,右心系を経由するカテーテル操作によって循環動態が悪化することが予想されていた.症例6では,基礎疾患が大動脈弁下心室中隔欠損,大動脈弁狭窄,大動脈縮窄を伴う両大血管右室起始症で,日齢2,体重1883 gにて両側肺動脈絞扼術を経て,生後5か月時に12 mm Contegra導管を用いたNorwood+Rastelli術が施行されていた.術直後よりContegra導管吻合部遠位の両側肺動脈分岐部狭窄が認められ,退院後,術後44日目に上気道炎罹患を契機にショック状態に陥り,心肺蘇生の上再入院となった.翌日,開胸下に右心耳脱血,上行大動脈送血によるCPSを導入,Contegra導管に6F 3 cmのショートシースを留置,両側の肺動脈分岐部にExpress Vascular SDステントをそれぞれ6 mmに拡大留置した(Fig. 7).CI手技終了後,ハイブリッド心カテ室内にてCPSから離脱し開胸下に循環器集中治療室に帰室.翌日縦隔内止血術を要し,その後縦隔洞炎を発症し洗浄および抗生剤投与により改善し退院となった.
小児領域のCPSは,血液の酸素化とともに循環補助を提供するECMOのほか,心室機能への直接的補助を提供する補助人工心臓(ventricular assist device; VAD)と大動脈バルーンパンピング(intraaortic balloon pumping; IABP)に分類される4).小児例ではIABPが適用される機会は少なく,当院へ体外設置式補助人工心臓システムが導入された時期が2016年以降であったことなどから,今回の研究の対象となった6例に導入されたCPSはすべてECMOであった.
ECMOの適応には,新生児期の重篤な呼吸器疾患の代表である遷延性肺高血圧症,横隔膜ヘルニアのほかに,心疾患領域では,(1)院内心停止に対する蘇生の一環としての導入(ECMO cardiopulmonary resuscitation; E-CPR),(2)低心拍出状態,(3)最大限の血管作動薬および人工呼吸管理においても遷延する低酸素状態,(4)人工心肺装置からの離脱不可,などが挙げられる5).小児領域で院外心停止を含めたE-CPRに関しては1980年代から6, 7),心臓外科手術後のECMO管理については1990年代から多数の報告がなされている8, 9).いずれも,ECMOの導入により明らかに救命には至っているものの,その離脱率,生存退院率は必ずしも高いとはいえない.年代や条件によって異なり,それぞれ概ね40~60%,25~40%と報告されている.
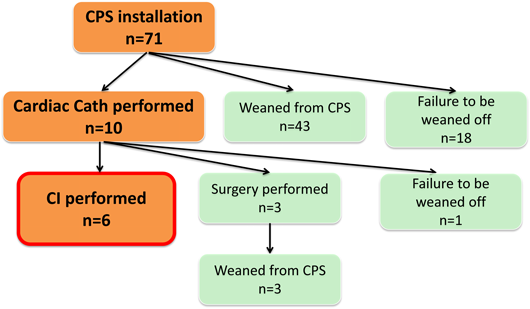
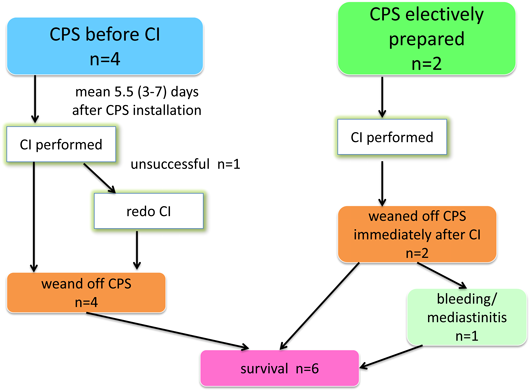
Fig. 2に示すように,今回の検討における当該期間中71例のECMO装着全装着例では,重度心筋症や劇症型心筋炎など,先天性心疾患に対する心臓外科術後例以外の循環不全も対象としている.そのうち,43例が集中治療の継続あるいは再手術により離脱可能となった.他の10例に対してCIあるいは病態診断目的でECMO装着下に心カテが施行された.CIを6例に施行,診断カテーテルに引き続き心臓外科再手術を3例に施行,いずれも離脱可能となった.症例数が少ない観察研究であるためCIの貢献度を科学的に評価することはできない.しかし,心臓外科手術後4ないし6週間といった早期のCI,あるいはCPS装着下のCIの安全性や有効性を示唆する報告は多く,またCPS装着となった症例には早期に再介入を行った方がよいことを示す報告も多い2, 3, 5, 10, 11).今回の検討で,ショック状態あるいは心臓外科手術後人工心肺離脱不可の理由でECMOを導入された4例においては,ECMO導入からCI施行までの期間は3~7日(平均5.5日)と,multi-disciplinary teamにおいて決断までに一定の検討・協議期間を要した.しかし,全例離脱には成功し,CIから離脱までの期間は1~6日(平均4.3日)と長期化しなかった.また,CI中の循環動態の安定化を目的として選択的にECMOを導入した2例においては,CI手技終了後同日内に離脱可能となった.総合的には,CPS下においても,カテーテルアブレーションも含めたあらゆるCIは,積極的かつ早期に適用すべき選択肢になると考えられる.
引用文献References
1) Agarwal HS, Wolfram KB, Saville BR, et al: Postoperative complications and association with outcomes in pediatric cardiac surgery. J Thorac Cardiovasc Surg 2014; 148: 609–616
2) Zahn EM, Dobrolet NC, Nykanen DG, et al: Interventional catheterization performed in the early postoperative period after congenital heart surgery in children. J Am Coll Cardiol 2004; 43: 1264–1269
3) Asoh K, Hickey E, Dorostkar PC, et al: Outcomes of emergent cardiac catheterization following pediatric cardiac surgery. Catheter Cardiovasc Interv 2009; 73: 933–940
4) Di Nardo M, MacLaren G, Marano M, et al: ECLS in Pediatric Cardiac Patients. Front Pediatr 2016; 4: 109
5) Kato A, Lo Rito M, Lee KJ, et al: Impacts of early cardiac catheterization for children with congenital heart disease supported by extracorporeal membrane oxygenation. Catheter Cardiovasc Interv 2017; 89: 898–905
6) Meliones JN, Custer JR, Snedecor S, et al: Extracorporeal life support for cardiac assist in pediatric patients: Review of ELSO Registry data. Circulation 1991; 84 Suppl III: 168–172
7) Brunner A, Dubois N, Rimensberger PC, et al: Identifying prognostic criteria for survival after resuscitation assisted by extracorporeal membrane oxygenation. Crit Care Res Pract 2016; 2016: 9521091
8) Chatzis AC, Giannopoulos NM, Tsoutsinos AJ, et al: Extracorporeal membrane oxygenation circulatory support after cardiac surgery. Transplant Proc 2004; 36: 1763–1765
9) Atik FA, Castro RS, Succi FM, et al: Use of centrifugal pump and extracorporeal membrane oxygenation as cardiopulmonary support in pediatric cardiovascular surgery. Arq Bras Cardiol 2008; 90: 216–220
10) Burke CR, Chan T, Rubio AE, et al: Early cardiac catheterization leads to shortened pediatric extracorporeal membrane oxygenation run duration. J Interv Cardiol 2017; 30: 170–176
11) Agarwal HS, Hardison DC, Saville BR, et al: Residual lesions in postoperative pediatric cardiac surgery patients receiving extracorporeal membrane oxygenation support. J Thorac Cardiovasc Surg 2014; 147: 434–441