動脈管開存症(PDA)は左心系への容量負荷に起因する心不全をはじめ,未熟児では頭蓋内出血,壊死性腸炎,肺出血,あるいは腎不全などの様々な合併症を引き起こす1, 2).新生児/乳児早期の症候性PDAに対しては従来から外科治療が選択されてきた.外科治療は薬物療法に比し効果は確実だが,出血,反回神経麻痺,横隔神経麻痺,乳糜胸,偽性瘤,あるいは創部感染などの合併症を生じる可能性がある1, 3).また,必ず左側開胸による術創が残る3).
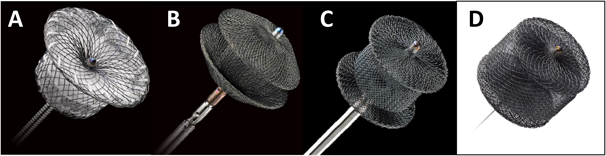
本邦では2016年11月から,Amplatzer™ Duct Occluder I(ADO I; St. Jude Medical Inc., Minnesota)の適応が拡大され,生後6か月未満あるいは体重6 kg未満の児もADO I留置が可能となった.これにともない,新生児/乳児早期の症候性PDAカテテール治療症例が今後増加してくると予測される.また,近年海外では新生児/乳児早期PDAに対し,他疾患治療用の閉鎖栓を用いたPDA閉鎖術(off-label use)が報告され,その有用性が注目されつつある(Fig. 1)1, 2, 4, 5).現在のところ,わが国における新生児/乳児早期症候性PDAのカテーテル治療成績に関して十分な知見はないため6),自施設における症例の検討を行った.
我々は2016年に初めて新生児に経カテーテル的動脈管閉鎖術を行った7).2例目以降は院内倫理委員会の承認を得てから治療を行い(承認番号432),現在までに計7例の新生児/早期乳児PDAにカテーテル閉鎖術を実施した(Table 1).以下,新生児/早期乳児症候性PDAにカテーテル治療を行うきっかけとなった一例(症例2)を提示する7).
Table 1 Characteristics of patients undergoing attempted transcatheter patent ductus arteriosus closur| Patient | Procedure weight (g) | Procedure age | Birth weight (g) | Gestational age (weeks) | Sex | PDA type | PDA minimum diameter (mm) | PDA diameter/length | Qp/Qs | Device type | Device size (mm) | Sheath size (Fr) | Complications | Follow-up period (months) | Underlying illness |
|---|
| 1 | 2,880 | 4 months | 635 | 25 | F | E | 1.1 | 0.13 | 1.1 | AVP II | 4 | 4 | none | 14 | BPD |
| 2 | 3,320 | 13 days | 2,860 | 37 | M | C | 4.8 | 0.62 | 6.6 | AVP II | 8 | 5 | LPA stenosis (spontaneous improvement) | 17 | pulmonary hemorrhage, DIC, ASD |
| 3 | 3,410 | 30 days | 3,218 | 40 | F | A | 3.7 | 0.67 | 4.8 | ADO I | 8/6 | 6 | none | 7 | Trisomy 21, ASD |
| 4 | 3,810 | 2 months | 2,205 | 38 | M | A | 4.2 | 0.52 | 8.2 | ADO I | 8/6 | 6 | none | 7 | Trisomy 21, pulmonary hemorrhage, ASD |
| 5 | 4,200 | 4 months | 2,922 | 38 | F | C | 5.3 | 0.61 | 3.8 | AVP II | 10 | 5 | Exacerbation of branch pulmonary stenosis | 8 | Trisomy 21, branch pulmonary stenosis, ASD |
| 6 | 5,180 | 5 months | 2,768 | 39 | F | A | 3.8 | 0.34 | 3.5 | ADO I | 8/6 | 6 | none | 11 | Trisomy 21 |
| 7 | 6,370 | 5 months | 2,560 | 36 | F | A | 2.4 | 0.42 | 1.1 | ADO I | 5/4 | 6 | none | 7 | Trisomy 21 |
| ADO I, Amplatzer™ Duct Occluder I; ASD, atrial septal defect; AVP II, Amplatzer™ Vascular Plug II; BPD, bronchopulmonary dysplasia; DIC, disseminated intravascular coagulation; LPA, left pulmonary artery; PDA, patent ductus arteriosus; Qp, pulmonary blood flow; Qs, systemic blood flow. All patients underwent transcatheter PDA closure by prograde approach. All but one (Patient No. 7) have pulmonary arterial hypertension. |
症例
日齢12,男児
現病歴
母体28歳,1経妊0経産.妊娠37週の妊婦健診で高血圧および尿蛋白陽性を指摘され,妊娠高血圧症候群のため前医に母体入院した.妊娠37週0日に胎児機能不全の疑いで緊急帝王切開が行われた.出生体重2,860 g, Apgar score 1分値4点,5分値8点,臍帯動脈血pH 7.032, BE −11.5 mmol/lであった.出生時から原因不明の播種性血管内凝固を発症した.心エコー図検査でPDAおよび心房間が両方向性短絡であり,奇異性チアノーゼを認めたため,新生児遷延性肺高血圧症と診断し,一酸化窒素吸入療法を行った.しかし経時的にPDA短絡は徐々に左→右方向に変化し,一酸化窒素中止後も多呼吸や乏尿等の症状が徐々に顕在化してきた.日齢12に突然の肺出血を契機に多臓器不全をきたし,全身状態が急激に増悪した.病勢コントロールのためにはPDAに対する治療介入が必要と判断され,同日当科に救急搬送された.
入院時現症
身長46.0 cm,体重3,319 g,体温39.0°C,心拍数189/min,呼吸数60/min,血圧72/38 mmHg, SpO2 98%(喚起モードSIMV, FiO2 0.5),頭頸部:大泉門平坦.顔貌異常なし.頸動脈怒張なし.胸部:II音肺動脈成分は単一亢進,奔馬調律あり.胸骨左縁第2肋間にLevine III/VI度の収縮期雑音を聴取.心尖部で拡張中期雑音を聴取.腹部:剣状突起下に肝臓を5 cm触知.脾腫あり.四肢:足背動脈は反跳脈.冷感あり.強い黄疸を認めた.
血液検査
白血球29,100/µL(好中球79%),血小板5.3万/µL, PT-INR 4.68, APTT 73.5秒,フィブリノーゲン54 mg/dL,アンチトロンビンIII 22%,FDP 61.5 µg/mL,総ビリルビン23.4 mg/dL,直接ビリルビン16.0 mg/dL, AST 2,772 IU/l, ALT 188IU/l, γGTP 123 IU/l, LDH 9,151 IU/l,フェリチン37,163 ng/dL, BUN 0.16 mg/dL,クレアチニン0.65 mg/dL, CRP 2.0 mg/dL, Na 141 mmol/l, K 5.0 mmol/l, Cl 103 mmol/l,ヒト脳性ナトリウム利尿ペプチド>800 pg/dL.
胸部X線
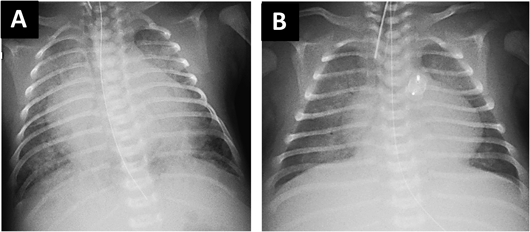
心胸郭比0.67.肺うっ血による血管陰影の増強および肺出血による硬化像が両肺野に認められた(Fig. 2A).
超音波検査
PDA径は肺動脈側4.6 mm,長径13.2 mm,大動脈膨大部7.8 mmであり,血流は両方向性(左→右短絡優位)であった.左室拡張末期径(LVEDD)22.2 mm(139%対正常値),左室駆出率(LVEF)48%,三尖弁逆流微量,僧帽弁逆流1度,肺動脈弁逆流微量であった.また頭部エコーでは脳内出血を示唆する高エコー領域が複数認められた.
治療経過
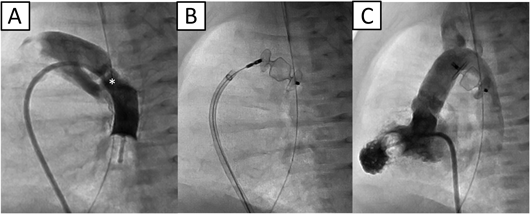
肺出血のコントロールのためにはPDAの閉鎖が必要と考えられたが,インドメタシンは臓器虚血を助長する可能性が高いこと,また外科治療は出血コントロールが困難になることが予想された.そのため経カテーテル的にPDAを閉鎖する方針としたが,当時新生児に対する閉鎖栓を用いたカテーテル治療はわが国ではoff-labelであったため,その旨を両親に十分に説明し,同意を得たうえで治療を行うこととした.日齢13に心臓カテーテル検査および経皮的PDA閉鎖術を行った.肺動脈圧38/15(平均25)mmHg,大動脈圧40/23(平均30)mmHg,肺体血流比(Qp/Qs)6.6,肺血管抵抗0.75 Wood U·m2であった.PDA経由バルーン閉塞大動脈造影側面像ではPDA形態はKrichenko分類8) C型で,サイズは肺動脈側4.8 mm,長径14 mm,膨大部7.8 mmであった(Fig. 3A).わが国で唯一使用可能なPDA閉鎖栓であるADO Iを用いた場合,閉鎖栓のサイズは10/8 mm以上を用いる必要があり,retention skirt径が16 mm以上と大きくなり過ぎてしまうため,大動脈損傷や医原性大動脈縮窄を生じる可能性が高いと判断した9).本症例にはADO II-additional sizes(ADO II-AS)が最適だが本邦では使用できないため,形態的にADO II-ASに類似したAmplatzer™ Vascular Plug(AVP; St. Jude Medical Inc., Minnesota)IIの8 mm閉鎖栓を選択した.5Fr先端孔バルーンカテーテル(ガデリウス・メディカル株式会社,東京)を用いて肺動脈からPDAを経由し下行大動脈へ0.025インチガイドワイヤー(ラジフォーカス®ガイドワイヤー;テルモ株式会社,東京)を留置した.次に5Frロングシース(Parent Plus™;メディキット株式会社,東京)へ交換したのち,AVP II 8 mmを留置した.両側のディスクがなるべくPDA内に収まるように心がけたが,近位側ディスクは主肺動脈側に展開された(Fig. 3B).重篤な合併症はなく,留置後の卵円孔経由左室造影ではPDAはほぼ完全に閉鎖されていた(Fig. 3C).治療翌日には心拡大(心胸比0.55)と肺うっ血の改善が認められ,高ビリルビン血症やDICも軽快した(Fig. 2B).転院65日目(日齢77)に退院した.退院時の心エコー図検査ではLVEDD 19.5 mm(117%対正常値),LVEF 80%,推定右室圧はほぼ正常に低下した.治療直後は軽度の左肺動脈狭窄(エコーでの推定圧較差:23 mmHg)を認めていたが,成長とともに軽快した.
過去に当院でPDAカテーテル閉鎖術を行った新生児/乳児早期動脈管開存症(生後6か月未満)は7例(女児5例)であった.これらの症例における臨床データ(手技,合併症,および転帰)を後方視的に検討した.全7例のまとめをTable 1に示す.在胎週数38(25–40)週,出生体重2,768(635–3,218)g,治療時年齢4か月(生後13日–5か月),治療時体重3,810(2,880–6,370)gであった.2例は早期産児(超低出生体重1例)であった.併存疾患はTrisomy 21(5例),二次孔心房中隔欠損(4例),肺出血(2例),播種性血管内凝固(1例),および慢性肺疾患(1例)であった.PDA最小径は3.8(1.1–5.3)mm,形態はKrichenko分類A型(4例),C型(2例),およびE型(1例)であった.肺体血流比は3.8(1.1–8.2)で,6例に肺高血圧を認めた.使用したデバイスはADO I(4例)およびAVP II(3例)であった.デリバリーシース挿入のためのガイドワイヤーは1例で0.025インチ,6例で0.035インチを使用していた.デリバリーシース径はADO Iを用いた症例はいずれも6Fr Torqvue™シース(St. Jude Medical Inc., Minnesota)で,AVP IIを用いた症例は4Fr Parent Plus™使用1例,5Fr Parent Plus™使用2例であった.ADO IおよびAVP IIは全例progradeアプローチで留置した.全例完全閉鎖可能であり,外科治療を要する重篤な合併症はなかった.AVP II留置例に左肺動脈分岐部狭窄を2例みとめ(症例2および5),うち1例は自然軽快した.
ADO Iを用いた経皮的動脈管閉鎖治療は2007年から本邦へ臨床導入されたものの,生後6か月以上および体重6 kg以上に限定するとされていた.2016年にそれらの限定事項が解除されて以降,当院では4例のADO I治療例を経験し合併症なく安全に治療することができた.
海外では以前から新生児/乳児早期の症候性PDAに対してADO Iを用いたカテーテル治療の報告がある10, 11).Fischerら10)は1歳未満の乳児12例(生後4.7か月[3週–11か月],体重4.4[2.6–8.7]kg)に対し,ADO Iを用いた塞栓術を行った.彼らは10例で完全閉鎖得たが,2例では留置不可能のため結紮術を必要とした10).閉鎖不可能であったこの2例は体重がそれぞれ2.6 kgおよび4.4 kgと,体格の小さい症例であった10).この研究結果から,Fischerら10)はADO Iによる動脈管塞栓術は,乳児期早期例においても有用であるが,広く普及するにはなお器具の改良が必要であると結論づけており,体重5 kg未満の児にはADO Iを推奨していない.手技的には,1)硬いデリバリーシースを小さな右室流出路にかなり無理な角度で進めるため,血行動態に影響を及ぼしやすいこと,2)シースを右室流出路から下行大動脈へ通過させる際,シースは急カーブを描くように走行するためADO Iを進める際に,シースが折れ曲がり(kinking)やすいことなどが指摘されている3, 10).Bilkisら11)は早期乳児例を含む209例(うち27%が体重5 kg未満の症例)にADO Iによるカテーテル塞栓術を行い,205例(98%)で完全閉塞を得た.良好な成績であったが,体重3.9 kgの症例でデリバリーシースの折れ曲がりが,5 kgの症例で軽度の大動脈縮窄が生じた11).このことからBilkisら11)もFischerら10)と同様に体重5 kg未満の症例にADO Iは推奨しないと結論づけた.これらの問題点を解決すべく,その後Amplatzer™シリーズからADO IIあるいはADO II-ASが登場した(Fig. 1)12).ADO IIおよびADO II-ASは従来のADOに比しlow profile(形状が小さく,より小さなシースで使用可能なこと13))であり,progradeおよびretrogradeともにアプローチ可能なことが特徴である12).Liddyら14)は177例のPDA症例に対しADO I, ADO II, ADO II-AS,あるいはFlipper coil等を用いて塞栓術を行い,その成績を比較検討した.彼らの検討ではADO I, ADO II,およびADO II-ASはPDAの形態によらず,治療効果および合併症の発症率はほぼ同等であった14).また最近の検討ではBackesら15)がKrichenko分類A型の未熟児PDA 4例に対してADO Iを用いて全例完全閉鎖に成功している.新生児/乳児早期のPDAカテーテル閉鎖術において最も重要な点は,肺動脈や大動脈などの動脈管に近接する血管が細く,二次性の左肺動脈狭窄や大動脈縮窄を生じやすい点であるが2–5, 10, 11, 15),過去の経験に基づいた症例選択やデバイスサイズの工夫等が治療成績の向上に寄与しているのかもしれない14, 15).
新生児/乳児早期の動脈管開存閉鎖デバイスに求められる要件は,(1)小さな留置システム(動脈アプローチなら4Fr,静脈アプローチなら6Fr程度が望ましい),(2)静脈から留置する場合は急峻な右室流出路のカーブを通過可能な柔軟性,(3)大動脈や肺動脈に突出する部分が薄く,小さく,しかも最小径4~5 mmくらいまでは閉鎖し得る形態,などが提唱されている6).従来,ADO I留置のためのデリバリーシースであるTorqvue™はその材質の硬さから新生児/乳児早期の適応に限界があるものと考えられていた6).新生児/乳児早期の症候性PDAでは体格に比してPDA径が太く,自験例でもPDA径中央値4.1 mmであり,閉鎖デバイスはADO I 8/6 mm, AVP II 8 mm以上が必要な症例が多かった.ADO I 8/6 mm留置のためには6Fr Torqvue™が望ましいが,AVP II 8 mmであれば5Frロングシース(我々はParent Plus™[メディキット株式会社]またはDestination®[テルモ株式会社]を頻用する)でのデリバリーが可能であり,体格の小さな新生児/乳児にも使用しやすい.また,今回我々がADO I留置を行った際に最も懸念していたことは,retention skirtによる下行大動脈の損傷であったが,結果的に重篤な合併症をきたした症例はなかった.ADO Iのデバイスサイズは従来通り「肺動脈側のデバイス径≧(PDA最小径+2)mm」9)で選択したが,新生児/早期乳児例においてもこの従来のデバイスサイズ基準で概ね問題はないものと考えられた.Backesら15)の報告ではAVP IIによるPDA閉鎖術を試みた48人中6人(13%)に左肺動脈狭窄あるいは大動脈縮窄が生じ,カテーテル治療を断念した.これらの患者のPDA形態はいずれもKrichenko分類C型であった15).Schwartzら2)はデバイス留置可能かどうかの指標としてPDA長の重要性を報告している.彼らは「PDAの最小径/長さ」が<0.4(長い形態)の症例は全例デバイス留置可能であったが,>0.5(短い形態)の症例は左肺動脈側や大動脈側にデバイスが突出してしまい,いずれも留置困難であったと報告している2).我々の3例の検討では「PDAの最小径/長さ」<0.4が1例,>0.5が2例であり,全例AVP II留置可能であった.症例2は前述したように治療直後は軽度の左肺動脈狭窄をみとめていたが,体格の成長にともない自然軽快した.症例5は治療前に両側肺動脈分岐部狭窄(圧較差15 mmHg)をみとめた症例で,PDA最小径5.3 mmに対し約2倍径の10 mmのAVP IIを留置した.デバイス留置直後は肺動脈分岐部の圧較差41 mmHgと増悪していたが,成長にともなう自然軽快を期待し経過観察した.治療後7か月のフォローアップカテーテルでは左肺動脈分岐部圧較差32 mmHgと治療直後に比し軽減していたが,今後も経過観察を要する状態であった.Backes15)やSchwartz2)らの報告は今後症例を蓄積して妥当性の再検証を行う必要があるが,現時点ではひとつの有用な治療判断基準になると思われる.PDA閉鎖におけるAVP IIのサイズ基準は「PDA最小径+1–2(mm)」や「PDA最小径の2倍」など様々なものが提唱されているが,今のところ定まった基準はない1, 2, 5, 15).過去の報告を参考にしながら,合併症のリスクをなるべく少なく,かつ最大の治療効果が得られるように,サイズ選択には工夫が必要であろう.
また自験7例中5例がtrisomy 21の児,3例が慢性肺疾患や肺出血を合併した重症例であった.Trisomy 21や未熟児慢性肺疾患では肺低形成あるいは異形成などがあるため,外科的手術による侵襲が大きい.そのためカテーテル治療のよい適応と考える.今回の我々の検討では,染色体異常や肺疾患をもつ新生児/乳児例においても安全にADO Iを留置できた.近年,重症先天性心疾患患児における早期カテーテルインターベンションの有用性が報告されている16, 17).Abrahamら16)によると,先天性心疾患を有する重症新生児症例では,早期カテーテルインターベンションを実施した群は,未治療群および手術群に比し生存率が優れていた.今回我々も症例2のように播種性血管内凝固および多臓器不全を合併した非常に重篤な状態の新生児例をAVP IIを用いて救命することができた7).またZahnら1)はAVP IIを用いた超低出生体重児6例(在胎週数26週,治療時日齢20,出生体重953 g,および治療時体重1,180 g)に対するAVP IIを用いたPDAカテーテル閉鎖術を行い,全例で完全閉鎖可能であり重篤な合併症はなかったと報告し,今後未熟児PDAへの治療適応拡大の可能性を示唆している.
新生児/早期乳児PDAに対しカテーテル閉鎖術を行った症例を検討した.提示した症例2のように,臨床現場ではカテーテル治療が最善の方法と考えられる状況に時おり遭遇するが,わが国においてはデバイスの導入が遅れていたり,使用適応範囲外であったりするなどの問題がある(device lag)18).Off-label useの治療で合併症が発生した場合,治療を行った臨床医が法的に守られることは非常に難しい18).我々小児科医はカテーテル治療のメリットおよびデメリットを他の認可されている治療法(薬物療法あるいは外科治療)のそれと十分に比較検討し,目の前の子どもたちにとって最善の治療法を選択していく必要がある18).また,臨床医や学会が,わが国の先天性心疾患患児がおかれている現状を報告し,カテーテル治療の必要性を継続的に働きかけていくことが重要であろう.
利益相反
日本Pediatric Interventional Cardiology学会の定める利益相反に関する開示事項はありません.
貢献度
岡田清吾は論文の構想,デザイン,データの収集・分析・解釈,および論文作成において貢献をした.宗内淳はデータの収集・分析・解釈,および論文作成または重要な知的内容に関わる批判的校閲において貢献をした.渡邉まみ江,杉谷雄一郎,長友雄作,飯田千晶,白水優光,川口直樹はデータの収集および重要な知的内容に関わる批判的校閲において貢献をした.
本論文の内容の一部は第28回日本Pediatric Interventional Cardiology学会学術集会で発表した.
引用文献References
1) Zahn EM, Nevin P, Simmons C, et al: A novel technique for transcatheter patent ductus arteriosus closure in extremely preterm infants using commercially available technology. Catheter Cardiovasc Interv 2015; 85: 240–248
2) Schwartz MC, Nykanen D, Winner LH, et al: Transcatheter patent ductus arteriosus occlusion in small infants. Congenit Heart Dis 2016; 11: 647–655
3) 鎌田政博.動脈管開存:乳児期早期例,低出生体重児に対するカテーテル治療の問題点.日小循誌2010; 26: 180–182
4) Philip R, Waller BR 3rd, Agrawal V, et al: Morphologic characterization of the patent ductus arteriosus in the premature infant and the choice of transcatheter occlusion device. Catheter Cardiovasc Interv 2016; 87: 310–317
5) Garay FJ, Aguirre D, Cárdenas L, et al: Use of the amplatzer vascular plug II device to occlude different types of patent ductus arteriosus in pediatric patients. J Interv Cardiol 2015; 28: 198–204
6) 富田 英,上村 茂,羽根田紀幸,ほか:6カ月以内の動脈管開存に対するコイル閉鎖術.日小循誌2010; 26: 176–179
7) Okada S, Muneuchi J, Nagatomo Y, et al: Transcatheter closure of a huge ductus arteriosus in a severely ill neonate. Int Heart J 2017 (in press)
8) Krichenko A, Benson LN, Burrows P, et al: Angiographic classification of the isolated, persistently patent ductus arteriosus and implications for percutaneous catheter occlusion. Am J Cardiol 1989; 63: 877–880
9) Alkamali AM: Patent ductus arteriosus closure. in: Butera G, Chessa M, Eicken A, Thomson J (eds.) Cardiac Catheterization for Congenital Heart Disease: From Fetal Life to Adulthood. Milan, Springer, 2015, pp. 489–506
10) Fischer G, Stieh J, Uebing A, et al: Transcatheter closure of persistent ductus arteriosus in infants using the Amplatzer duct occluder. Heart 2001; 86: 444–447
11) Bilkis AA, Alwi M, Hasri S, et al: The Amplatzer duct occluder: experience in 209 patients. J Am Coll Cardiol 2001; 37: 258–261
12) Butera G, Chessa M, Eicken A, et al (eds.): Cardiac Catheterization for Congenital Heart Disease: From Fetal Life to Adulthood, Springer, Milan, 2015
13) 片岡功一:バルーン肺動脈弁形成術/バルーン肺動脈形成術.Journal of JPIC 2016; 1: 43–52, doi: 10.20599/jjpic.1.43
14) Liddy S, Oslizlok P, Walsh KP: Comparison of the results of transcatheter closure of patent ductus arteriosus with newer Amplatzer devices. Catheter Cardiovasc Interv 2013; 82: 253–259
15) Backes CH, Cheatham SL, Deyo GM, et al: Percutaneous Patent Ductus Arteriosus (PDA) closure in very preterm infants: Feasibility and complications. J Am Heart Assoc 2016; 5: e002923
16) Abraham BP, Gilliam E, Kim DW, et al: Early catheterization after initiation of extracorporeal membrane oxygenation support in children is associated with improved survival. Catheter Cardiovasc Interv 2016; 88: 592–599
17) Kato A, Lo Rito M, Lee KJ, et al: Impacts of early cardiac catheterization for children with congenital heart disease supported by extracorporeal membrane oxygenation. Catheter Cardiovasc Interv 2017; 89: 898–905
18) 中川直美,鎌田政博,石口由希子,ほか:Device lag; 我が国の現状と課題.Journal of JPIC 2016; 1: 2–12, doi: 10.20599/jjpic.1.2