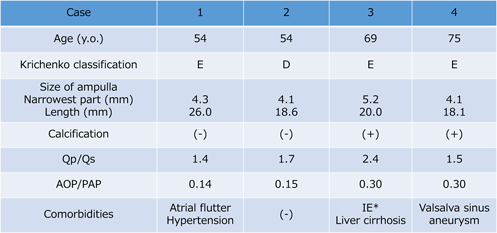
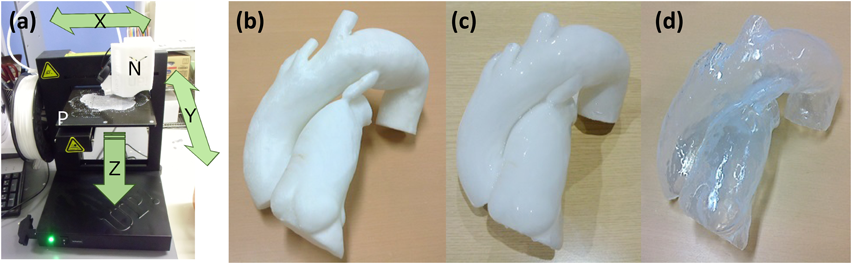
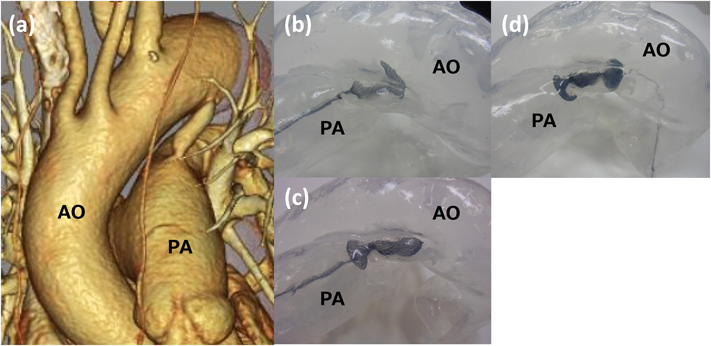
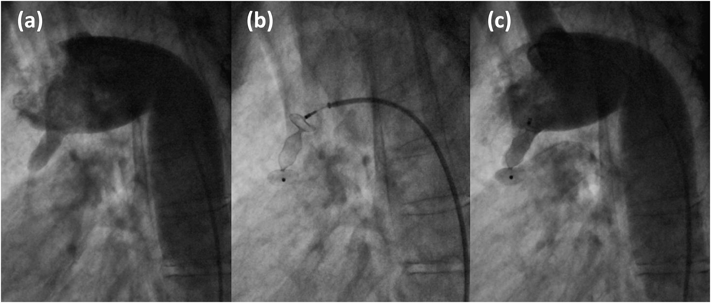
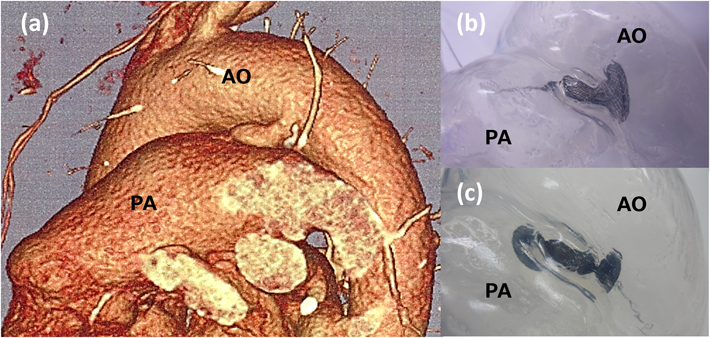
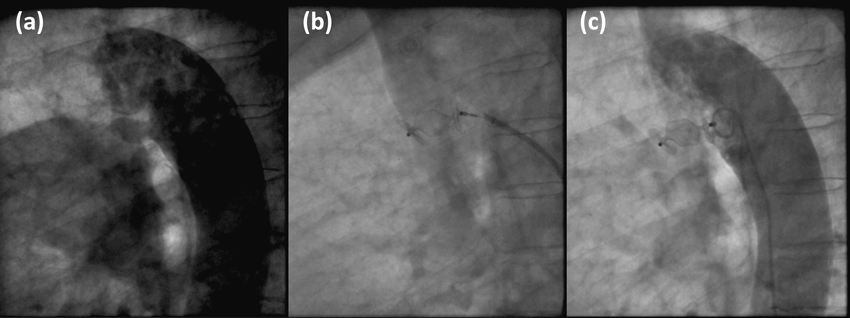
患者データから自施設で作製した中空立体模型を用いた,成人動脈管開存の経皮的閉鎖術シミュレーションSimulation using patient-specific hollow three-dimensional models for percutaneous closure of patent ductus arteriosus in adult
1 自治医科大学とちぎ子ども医療センター小児手術・集中治療部Pediatric Operating Suite and Intensive Care Unit, Jichi Children’s Medical Center Tochigi ◇ Tochigi, Japan
2 自治医科大学小児科Department of Pediatrics, Jichi Medical University ◇ Tochigi, Japan
3 自治医科大学成人先天性心疾患センターAdult Congenital Heart Disease Center, Jichi Medical University ◇ Tochigi, Japan
4 自治医科大学とちぎ子ども医療センター小児・先天性心臓血管外科Pediatric and Congenital Cardiovascular Surgery, Jichi Children’s Medical Center Tochigi ◇ Tochigi, Japan