バルーンカテーテルを用いた肺動脈弁形成術(percutaneous transluminal pulmonary valvuloplasty: PTPV,もしくはballoon pulmonary valvuloplasty: BPV)およびバルーン血管形成術(percutaneous transluminal angioplasty: PTA)は30年以上の歴史を有し,心臓カテーテル治療の中でも最も確立された分野である.今では先天性心疾患の治療戦略上欠くことのできない治療法として普及しており,今後も重要性は高まっていくと考えられる.現在,本邦ではPTPVおよび肺動脈へのPTAに関して,2つのガイドラインがある.すなわち,日本小児循環器学会と本学会とで作成された「先天性および小児期発症心疾患に対するカテーテル治療の適応ガイドライン」(以下,適応ガイドライン)1),日本小児循環器学会,本学会のほか,日本循環器学会,日本心臓病学会など複数の学会の合同研究班によって作成された「先天性心疾患,心臓大血管の構造的疾患(structural heart disease)に対するカテーテル治療のガイドライン」(以下,治療ガイドライン)2)である.使用するバルーンの選択や手技に関しては詳述された優れた教科書があり3–8),また治療成績や合併症についても多くの論文がある.本稿では第28回日本Pediatric Interventional Cardiology学会学術集会(2016年1月,広島)での教育講演内容に準拠し,新生児期重症肺動脈弁狭窄(critical pulmonary stenosis: critical PS)を除く肺動脈弁狭窄のPTPVおよび肺動脈のPTAについて概説するとともに,あまり教科書には記載されていない実臨床上の手技の工夫についても簡単に述べたい.
1. バルーンカテーテルに関する用語
Profile, Trackability, Pushability, Crossability, Compliantなど,バルーンカテーテルの性質を表現する特有の用語がある.日本語ではニュアンスが伝わりにくく,和訳せずにそのまま用いられることが多い.製品の添付文書,臨床の現場や学術集会などでも使用されるが,馴染みのない入門者には理解しにくい面がある.Profileは「輪郭形状」などと訳されることもあるが,low profileとは形状が小さく,より小さなシースで使用可能となり狭窄部や細い血管を通過させ易いといった意味で使われることが多い.Trackabilityは,血管形態やガイドワイヤへの「追従性能」と訳される.Pushabilityは「押し込み性能」,Crossabilityは「通過性能」と訳され,病変部への到達性能を示す用語である.Compliantは適切な和訳がないが,加圧に従ってバルーンが膨らむ性質を表す.Non-compliantバルーンは,加圧を強めても表示された直径以上には拡大しない性質を表している.
2. コンプライアンスによる分類
現在PTPVやPTAで用いられるバルーンは,コンプライアンスから“Semi-compliant”と“Non-compliant”に分けられる.“Non-compliant”バルーンは“Low-compliant”バルーンと呼ばれることもあり,“High-pressure”バルーンとほぼ同義で用いられる.以下,それぞれの特徴と使い方を簡単に述べる.“Semi-compliant”バルーンはやわらかい素材でできており,血管の通過性が高く病変部への到達性に優れているが耐圧は低めで,狭窄病変の拡張力は“Non-compliant”バルーンに比べると劣っている.加圧に応じてバルーン径が変化するため,拡張径を細かく調整しうる利点も有している.比較的膨らみやすいうえに一気に膨らまないことから血管損傷予防の点では有利である.しかし狭窄部の前後が膨らむ「Dog bone現象」を起こすため,硬い病変では狭窄前後の健常部に過剰な圧がかかりバルーン破裂の危険性がある.“Non-compliant”バルーンはpolyethylene terephthalate(PET)などの固い素材でできており,狭窄病変の拡張力に優れるが,血管通過性はやや劣る.バルーン径が圧にほとんど依存せず比較的一定値を保つため,Dog bone現象を起こさない利点を有する.高圧でもあまり膨らまないため高度な狭窄や石灰化病変に有効である.
3. 耐圧による分類
バルーンカテーテルの素材により耐圧が異なり,おおむね通常耐圧(6気圧以下),高耐圧(6~15気圧),超高耐圧(15気圧以上)に分けられる.バルーンの耐圧に関する用語では,推奨拡張圧ないし規定圧(Nominal pressure: NP)と最大拡張圧ないし定格破裂圧(Rated burst pressure: RBP)が重要である.推奨拡張圧はパッケージに表示されたバルーン径に達する圧である.バルーンカテーテルの添付文書には「バルーンの拡張圧は,最大拡張圧(RBP)を超えないこと」と記載されている.最大拡張圧はin vitro試験の結果に基づいて決められており,少なくとも99.9%のバルーンは(95%の信頼性で)最大拡張圧以下では破裂しない.すなわち,バルーンの破裂を起こすことなく安全に拡張可能だとメーカーが判断している,拡張圧の上限値といえる.Semi-compliantバルーンは,最大拡張圧で拡張すると表示されたバルーン径よりも少し大きくなる.
4. Over the wire (OTW) typeとRapid exchange (RX) type
バルーンカテーテルを目的部位に到達させるためには,ガイドワイヤの支持が必要である.カテーテルの手元から先端まで全長にわたりガイドワイヤが通る“Over the wire type(OTW)”と,先端部分にだけガイドワイヤが通る“Rapid exchange type(RX)=Monorail type”がある.OTWは高いpushabilityやバルーンを留置したままガイドワイヤが交換可能である利点を有する.ただしバルーンカテーテルを入れ替える際にはバルーンシャフトの2倍の長いワイヤを要する.RXは短いワイヤで速やかにバルーンカテーテルの入れ替えが可能であること,すなわち“rapid exchangeable”である利点を有する.Low profileで良好なtrackabilityも特長であるが,OTWに比べるとpushabilityはやや劣るとされている.現在,成人循環器内科領域でのバルーン冠動脈形成術では,RXが主流になっている.
5. バルーン操作の基本
バルーンにかかる圧を正確に把握し,制御しつつ加圧することは,血管損傷やバルーン破裂などを予防するために重要である.バルーンのinflation/deflationには通常インデフレーターが用いられる.バルーンのinflationとdeflationを迅速に行うために,造影剤を生理食塩水で希釈して濃度を1/2以下にする.通常は1/4濃度でも透視での視認性は良好である9).拡張手技を終え,バルーンをシース内に回収する際には,陰圧をかけ回転させながら回収するとスムーズにいくことが多い.「朝顔のつぼみ」の形状をイメージしてバルーン部を巻くように回収する.しかし,過度の陰圧がかかるとバルーンシャフトが曲がり,かえって回収しにくくなることがある.
1. 肺動脈弁狭窄
先天性肺動脈弁狭窄(congenital pulmonary valve stenosis)は,単独では先天性心疾患の8~10%にみられ8),多くはドーム状の肺動脈弁である8, 10).交連が癒合し弁尖が円錐状に肺動脈内に突出する形態で,高度な狭窄では有効な開口部が針孔状になっていることもある.狭窄の重症度は,右室収縮期圧から軽症(50 mmHg未満),中等症(50 mmHg~体血圧),重症(体血圧を超える)に分けられる2).癒合した交連(raphae)数は0~7と様々である9).10~20%と低頻度ながら,異形成肺動脈弁や肺動脈弁輪の低形成もみられる8, 11).異形成肺動脈弁は,弁尖が厚く可動性が乏しい,肺動脈の狭窄後拡張が明らかでないなどの特徴を有し,時に弁上部狭窄様の所見がみられる2).異形成肺動脈弁はNoonan症候群に合併することが多い.
2. PTPVの適応
現在行われているように,狭窄した肺動脈弁にバルーンカテーテルを通過させ,同部位でバルーンをinflationし肺動脈弁を拡張するPTPVは,1979年にGrüntzigらが報告した冠動脈狭窄に対するバルーン形成術12)を応用し,1982年にKanらによって初めて報告された13).以後数多くの成功例が報告され世界中に普及し,現在では外科手術に代わる第一選択の治療として位置づけられている1, 2).
ガイドラインに基づくPTPVの適応は,「肺動脈弁の前後で40 mmHg以上の圧較差を認める肺動脈弁狭窄」で,適応ガイドラインでは心エコー検査による測定値1),治療ガイドラインでは心エコー検査および心臓カテーテル検査による測定値とされている2).心エコー検査では,連続波Doppler法を用いて肺動脈弁口部の血流波形を記録し,簡易Bernoulliの式から瞬時最大圧較差(maximum gradient)を測定するが,多くの場合心臓カテーテル検査で測定する圧較差(peak-to-peak gradient)よりも大きな値となる.ただし高度の肺動脈弁狭窄の場合,心臓カテーテル検査の圧測定では,狭小な肺動脈弁口をカテーテルが通過することにより狭窄を過大評価する可能性もある.いずれの測定法も正常の心拍出が維持されていることが前提になっており,ガイドラインでは「右室機能不全を有する臨床的に明らかな肺動脈弁狭窄」もPTPVの適応とされている(クラスI,レベルC)1, 2).右室機能障害は加齢とともに出現してくることが知られており,乳幼児期の治療が望ましい.体格なども考慮すれば,中等症は2~5歳(できれば6ヵ月以降)が最適年齢で,新生児の重症例(critical PS)は圧較差にかかわらず,ただちに治療すべきである2).無症状の成人に対してのPTPVの適応は議論の分かれるところであるが,運動耐容能が低いこと14),心筋の線維化が進行する潜在的な危険性があることから治療すべきとする考えがある9).成人の石灰化を伴う肺動脈弁狭窄に対してもPTPVの有効性が報告されている11).高齢者でもPTPVは可能で,小児から成人,老人まで年齢制限はない2).ただし成人期の症例でPTPVの適応を検討する場合には,①弁の性状(石灰化の評価),②右室流出路狭窄の程度,③他の外科的治療を必要とする心内病変がないか,を十分検討しておく必要がある2).圧較差25 mmHg以下の軽症例で圧較差の増大はないとされ15),自然軽快することも多い.
異形成肺動脈弁では,円錐状の典型的な肺動脈弁狭窄に比べPTPVの有効性は低く,適応ガイドラインではクラスIでなくIIa(レベルC)1),治療ガイドラインではIIb(レベルC)に分類されている2).有効性の観点から議論の分かれるところではあるが,手技に伴う合併症の発生頻度が低いことから,Noonan症候群の異形成肺動脈弁に対してもPTPVが施行されている2).
3. PTPV手技
PTPVでは石灰化の高度な症例を除き,6気圧未満の通常耐圧バルーンが選択される.確実な治療効果を得るために,かつては肺動脈弁輪径の140~150%と大きめのバルーン径が選択されていた1, 2).弁輪破裂や右室流出路損傷の危険性9),肺動脈弁逆流(pulmonary regurgitation: PR)の悪化を考慮して小さめのバルーンが使用されるようになり,最近では120~125%のバルーンが推奨されている1, 2, 9).使用するバルーンカテーテルに合わせガイドワイヤを選択するが,硬いガイドワイヤのほうが支持力は高く安定性がよい.ガイドワイヤは左右どちらかの肺動脈の可及的末梢分枝に留置し固定性を高める4, 6).肺動脈弁狭窄が高度で目標とする直径のバルーンカテーテルを通過させることが難しければ,サイズダウンしてよりlow profileのバルーンカテーテルを通過させpredilatationを行い,その後に目標径のバルーンでPTPVを行う4, 6, 9).バルーンカテーテルの入れ替え時には,ガイドワイヤを肺動脈末梢枝に十分深く留置し,逸脱しないよう注意する.硬いガイドワイヤを使用する際にはカテーテルの剛性が高まるため,PTPV手技中は心房・心室の伸展や刺激伝導路の圧迫による期外収縮や房室ブロックなどの不整脈,高度な三尖弁逆流を惹起する可能性にも注意すべきである.体血圧と心拍数,心電図,経皮酸素飽和度のモニタリングを行う.
カテーテルを右室から肺動脈に進める際には,三尖弁腱索間隙を通過させぬよう注意が必要で,wedge用Bermanカテーテルなどバルーンを膨らませた状態で右室から肺動脈に上げるとよい.Bermanカテーテルでの肺動脈弁通過が困難であれば,多目的カテーテルや右冠動脈用カテーテルを注意ぶかく使用する.このような具体的な器材の選択と手技については,前述の教科書に詳述されている4, 6).
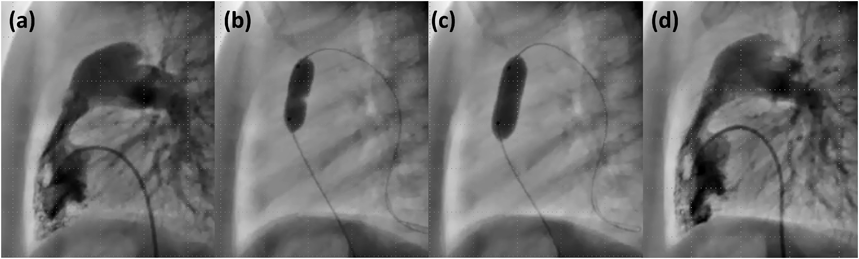
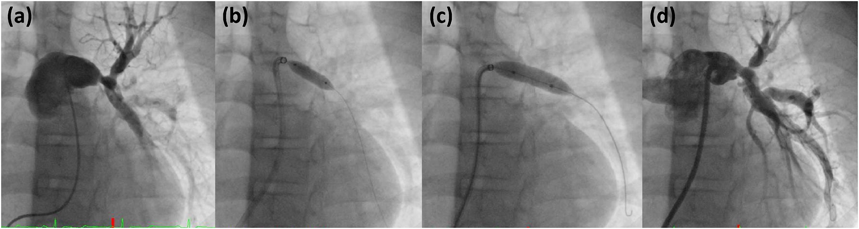
シングルバルーン法のPTPVでは,inflationしている間肺血流を完全に遮断することになる4, 9).動脈圧をモニタリングした報告では,肺動脈弁を5秒間閉塞した場合に比べ,10秒間閉塞した場合のほうが動脈圧の低下がより顕著であり16),リアルタイムで血圧を把握できるよう観血的動脈圧モニタリングが推奨されている9).また,肺血流の遮断に伴い,一過性に徐脈や低酸素血症をきたすことも知られている6, 9).可及的に短時間でのinflation/deflationを心がけ,“waist”が出現し消失したら速やかにdeflationし,inflation/deflation全行程を10~15秒程度に抑えるようにする4)(Fig. 1).Deflationの際にはバルーンを主肺動脈側(遠位)に押し込むようにすると,バルーンによる肺動脈弁の閉塞時間を減じることができ,ガイドワイヤが逸脱してしまうトラブルも避けることができる.Inflation回数の増加は遺残狭窄に対し明らかには影響しないとされるが,弁形成の効果を確実にするためにwaist消失後1回の追加拡張6)を施行するか否かは,術者の判断による9).典型的なドーム状の肺動脈弁におけるPTPVの効果機序は,多くの場合が癒合した交連の裂開である17, 18).
「より安全」で,「より効果的」な手技を目指すことはカテーテル治療の大原則であり,教科書に記載されるような基本手技に加えて,臨床の現場では各施設・施術者において様々な工夫がなされている.筆者の施設では,PTPVの際,血圧低下の予防目的でステロイド(hydrocortisone)の経静脈投与,徐脈の予防目的でatropineの経静脈投与,低酸素血症の予防目的で酸素吸入などを併用している.予防目的の薬剤投与の適否については議論の余地もあろうが,“risk and benefit balance”の観点から,「予防可能な合併症を確実に予防する」手段を講じることは極めて重要であると考えている.
あらゆるカテーテル治療において,手順をよく検討しておくことは重要である.PTPVに関しては,PTPV前の血圧測定,右室などの造影,PTPV手技,PTPV後の血圧測定,右室造影といった手順が考えられる.狭窄が高度でカテーテルを右室から肺動脈に進めることが容易でない場合には,先に右室造影を行い右室流出路や肺動脈弁の形態を把握し,その画像を参照しながら手技を行うとよい.治療の効果を判定するには,通常PTPV前後で右室–肺動脈間の引き抜き圧較差を測定するが,狭窄肺動脈弁を通過させたバルーンカテーテルをいったん抜去する必要が生じる.右室圧,肺動脈圧と順に測定後,引き抜き圧較差を測定せず,そのままPTPV手技に移行したほうがよい場合もある.検査データの収集は重要であるが,患者を安全に治療することはより重要で優先されるべきであり,臨床の現場では柔軟な対応が求められる.上述のような状況を解決するためには,静脈側シースを1本追加留置しておくことが勧められる7).狭窄肺動脈弁を通過させたガイドワイヤを抜去することなくカテーテルの交換ができ,右室と肺動脈の血圧を同時に計測することでPTPV後の圧較差を調べることができる.また肺動脈弁にガイドワイヤを通過させたまま右室造影を行い,PTPV後の形態変化を確認し,必要に応じPTPVを追加することもできる.
鎮静については,比較的短時間でPTPV手技が終了することもあり,特に年長児以上では通常局所麻酔で施行可能で全身麻酔は必要ない.しかし,重症例や乳児など血行動態の不安定が予想される症例では全身麻酔/人工呼吸管理下に施行したほうが安全である4, 6).施設の経験症例数や方針によって決定すべきである6).
4. 治療成績と合併症/続発症
異形成肺動脈弁を除き,PTPVの成績は短期,長期とも良好で2, 11, 19, 20),PTPVを施行しえた90%以上の症例で急性期に効果がみられるとされている8).PTPV後の再狭窄は約8~10%で起こるとされている21).使用したバルーンの大きさと治療効果についての報告では,治療効果を維持できた群の平均バルーン径は肺動脈弁輪径の114%であり,維持できなかった群は107%であった11).
PRの発生は右室の拡大や機能不全をきたすが,PTPV後10~40%の症例に生じるとされる1, 2).他の報告では長期的な経過観察中40~90%と高率にみられるとされ9),PTPV後の時間経過とともに発生率と重症度が高まる16).中央値5.6年の観察期間で,中等症以上のPRがみられた症例は7%から29%に増加したとする報告がある22).PRの発生率は高いものの,肺動脈弁置換を要する程度まで右室拡大が進行したとする報告はほとんどない.しかし,平均7.2年の観察期間で,107症例中6症例(6%)が肺動脈弁置換を考慮すべき重症のPRに進行したとする報告があり,低年齢でのPTPV施行,高度な狭窄,大きな径のバルーン(肺動脈弁輪径の144%)使用,non-compliantバルーン使用,PTPV後の遺残圧較差低値がPR進行の危険因子として挙げられている23).PTPV後のPRについて,MRI検査で測定した肺動脈弁の逆流率(PR fraction)が15%を超える症例は,15%以下の症例に比べ運動耐容能が低下していたとする報告があり24),完全な狭窄解除を目指すよりも,軽症の遺残狭窄を許容して明らかなPRを避けたほうがよいとする考えもある8).
PTPV後十分な肺動脈弁の可動性が得られたにもかかわらず,術直後に右室圧が低下しないことがある.右室肥大に伴う一過性の右室流出路狭窄によるもので30%近くにみられ,年長で狭窄が高度な症例ほど頻度が高く25),長期に右室の圧負荷がかかった成人症例で多くみられる.心筋肥厚の改善とともに次第に軽減することが多いが,50 mmHg以上の高度な狭窄症例ではβ遮断薬を使用して速やかな改善をはかる6, 9).
PTPVに伴う合併症の発生率は1990年の大規模な調査研究で,死亡が0.24%,重大な合併症が0.35%とされている26).同報告は26施設の症例登録に基づき,初期の症例も多く含んでいる.現在では重大な合併症の発生率は極めて低いと考えられるが,緊急で輸血を要する状況に備えておくことも勧められる4).
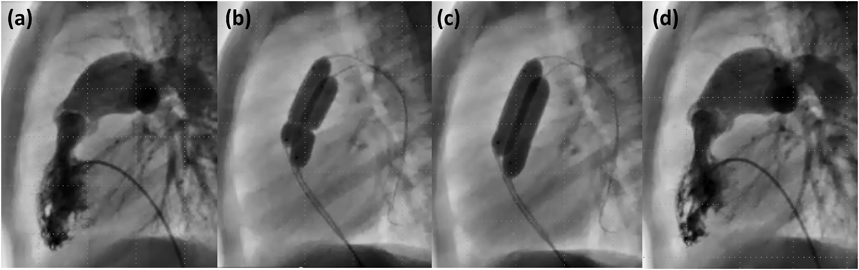
5. ダブルバルーン法
拡大目標径が大きい年長児や成人では,ダブルバルーン法を用いる27–29)(Fig. 2).肺動脈弁輪径20 mm以上の症例が適応となる2, 8).バルーンカテーテルの操作性を考慮し,通常は両側大腿静脈からアプローチするが,同側でも構わない3).ガイドワイヤは2本とも同側の肺動脈内で可及的に遠位まで挿入し留置・固定するのがよいが,必ずしも同じ分枝に挿入する必要はない3).2個のバルーンサイズの選択にあたっては,有効なバルーン径に相当するシングルバルーンでの直径を求める換算式がいくつか提唱されている30, 31).臨床の現場では,使用する2個のバルーンサイズ(それぞれの直径をD1, D2とする)には通常極端な差はないと考えられるため,簡便なRaoの換算式:{D1+D2+π(D1/2+D2/2)}/πに基づいて計算するのがよい32).この式を簡便化したNarangの式:0.82(D1+D2)が扱いやすい33).
ダブルバルーン法の利点として①小さなバルーンカテーテル/シースを使用するため血管損傷をきたしにくく,各々のinflation/deflationが短時間で可能であること,②高耐圧のバルーンカテーテルが使用可能で,拡張の有効性が高まること,③理論的に肺動脈弁を完全閉塞しないため,PTPV中体血圧が低下しにくいことなどが挙げられる.一方,問題点として①手技が煩雑になること,②多くの人員を要すること,③医療経済性に劣ることが挙げられる.静脈アクセスは最低2ヵ所必要になるが,血管径の小さな児でダブルバルーン法が選択される場合がある.また成人や術後の狭窄症例で石灰化を伴う肺動脈弁では,より高耐圧のバルーンを要しダブルバルーン法が選択される.
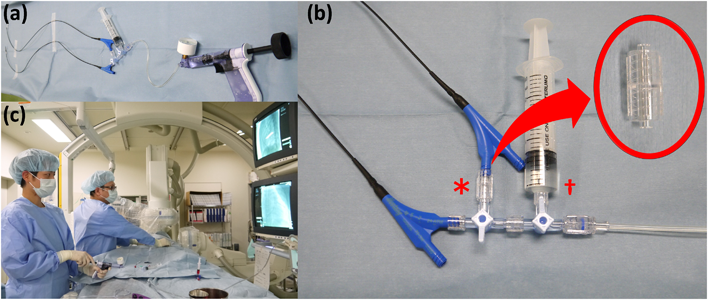
筆者の施設ではダブルバルーン法の際,2個のバルーンカテーテルをコネクター(オス/オス)で接続し,1個のインデフレーターでinflation/deflationを行う「シングルインデフレーター法」を採用している.同法はシステムの構築が容易で,最低2人と少ない人員で施行できる利点を有する(Fig. 3).またバルーンinflationのタイミングを合わせることができ,医療経済性にも優れている.懸念されるinflation/deflationの時間については,deflation用のシリンジを装着し短縮化をはかっている.
1. 肺動脈狭窄
肺動脈狭窄は先天性心疾患の2~3%にみられ8, 34),多くはFallot四徴や類縁疾患など他の先天性心疾患に合併する.末梢性の肺動脈狭窄は先天性風疹症候群やWilliams症候群(染色体7q11.23の微細欠失),Alagille症候群(染色体20p12の単一遺伝子欠損),Noonan症候群,Ehlers–Danlos症候群等での合併が知られている8).狭窄部位は主幹部から末梢まで様々にみられ,単独の狭窄もあるが多くは多発性で,Gayらの分類が知られている35).先天性肺動脈狭窄の病因は,肺動脈の各セグメントの発生の差に基づいて異なり,多因子的であると考えられている.風疹ウイルスが弾性板の発生を障害することなどから,なんらかの催奇性因子の関与が推測されるが確定的ではない8).上述の多くの症候群においては,特定の遺伝子異常による発生の障害であることが解明されつつある.先天性心疾患に対する心臓血管外科手術の進歩に伴い,最近では術後の瘢痕性肺動脈狭窄症例の頻度が最も高くなっている.
2. PTAの効果機序
PTAにより有効な拡大を得るためには,バルーンにより狭窄部やその周辺を過拡大する必要があり,内膜から中膜層に亀裂が認められることが多い2, 5).通常は血管壁の最も脆弱な部分に亀裂が生じるが,時間経過とともに内膜組織で修復される.中膜全層から外膜との境界である外弾性版にまで亀裂が及ぶと,仮性動脈瘤を生じることがある.術後急性期症例などでの血栓狭窄やプラークによる狭窄,Blalock–Taussig短絡術など導管内狭窄の場合には,バルーンのinflationによる血栓やプラークの肺動脈壁への圧着がPTAの主な効果機序と考えられる.
1980年のMartinらによる経皮的血管形成術を施行した14症例の報告に,末梢肺動脈狭窄に対しPTAを施行した最初の1症例が含まれていた36).1981年にLockらは,羊新生仔を用いて外科的に縫縮・作製した分岐部肺動脈狭窄に対し,PTAを施行した実験結果を報告した.同報告では病理組織学的検討も行い,バルーンによる亀裂が内膜から中膜・外膜に及んでいること,この亀裂は時間経過とともに内膜組織で覆われることなども述べられている37).続いてLockらはPTAを臨床応用し,1983年に小児5症例に対する6回のPTAを報告した.有効な拡大の機序は“intimal tear”であったとする一方で,過大なバルーン使用による血管破裂やガイドワイヤによる血管穿孔など潜在的な危険性についても考察している38).
3. PTAの適応
PTAの適応を考えるには,まず狭窄の原因・病態を整理して考える必要がある.すなわち①術後の瘢痕性狭窄:Blalock-Taussig短絡術後の狭窄,主要体肺側副動脈の肺内肺動脈統合術(unifocalization)後の狭窄,パッチ拡大術後のパッチ辺縁部の狭窄等,②血管組織自体の低形成・過形成による組織学的な狭窄:Williams症候群やAllagile症候群でみられる末梢性肺動脈狭窄等,③血管屈曲や周囲組織からの圧迫による形態変化:Fallot四徴術後の左肺動脈分岐部(屈曲)狭窄,完全大血管転位Jatene手術(Le Compte法)後の後方大動脈からの圧迫による肺動脈分岐部狭窄等である.血管造影検査で狭窄の形態を正確に評価するためには,病変の長軸に直角となるよう撮影角度を設定する必要がある.CT検査・MRI検査で評価する場合には,任意の角度で断面像が設定できる特性を活かし,病変の長軸および短軸の両方向で観察する.画像を立体(3D)化して形態を把握できること,周囲組織との位置関係を把握できることは両検査の大きな利点である.入院せず外来でも施行可能であり,経時的変化の評価に利用しやすい.
肺動脈主幹部の狭窄では右室収縮期圧/左室収縮期圧(大動脈収縮期圧)2/3以上の場合に適応となる2).末梢肺動脈狭窄では,一般的には狭窄部前後での圧較差15~20 mmHg以上がPTAの適応であるが,分岐部末梢性肺動脈狭窄では健側肺が代償するため圧較差は参考にとどめ,造影検査による形態や肺血流シンチグラフィ(患側/健側肺血流0.5未満,ないし35%/65%未満)を勘案して決定する2).Glenn手術・Fontan手術後や心機能低下症例では,圧較差や肺血流比では判断することができないため形態に基づき適応を判断する.各症候群に伴う肺動脈狭窄は血管壁の構造異常を伴うことも多いため,PTAによる治療効果と血管破裂などの危険性を十分に検討したうえでPTAの適応を決定する.
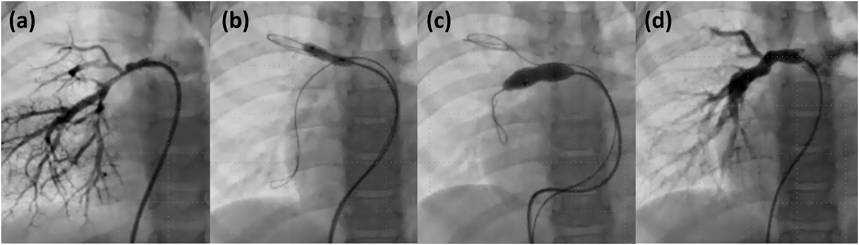
PTAの大きな利点は,狭窄拡張後に血管の成長が期待できることである7)(Fig. 4).本邦では使用可能なステントに制限があることからも,成長途上の小児においてはPTAが選択されることが多い1).通常のPTAが無効な症例では,後述するカッティングバルーンの併用やステント留置が考慮される1, 2, 7).
4. PTA手技
術後瘢痕性狭窄では,有効性が高い6~15 atmの高耐圧バルーンが使用されることが多い.最近では≧15 atmの超高耐圧バルーンも普及してきた.より大きなシースを要し,病変部への到達性がやや劣る点は不利であるが,特に硬い病変で使用される.使用するバルーン径は,最狭窄部径の300~350%で参照血管径の150%を超えないことを原則とする7).超高耐圧バルーンを使用する場合には,200%程度までにとどめた方がよい.未治療の肺動脈狭窄では最狭窄部径の300%未満かつ参照血管径の110~115%を超えないようにし5),より慎重にinflationを行う.
通常はバルーンの位置を遠位側から近位側にずらしながら拡張する.大きな径のバルーンが末梢の細い肺動脈に入り込むと,inflationにより血管損傷をきたすおそれがある.PTPVと異なり,バルーン拡大の際にも他の分枝への血流は維持されるため,通常血行動態が不安定になることはない.まずは比較的緩徐にinflationを行い,低圧で病変部に対するバルーンの位置を確認することが重要である5).細い末梢肺動脈への損傷を避けるには,shoulderの短いバルーンカテーテルを選択するとよい.硬いガイドワイヤのほうが支持力は高く,狭窄病変を超えて十分末梢にまで挿入しておく必要がある5, 7).硬いガイドワイヤでfloppyな先端部分が短いものは,末梢血管を穿通する危険性があるため慎重な操作を心がける5).
末梢肺動脈狭窄のPTAでwaistが残存する場合,血圧や経皮酸素飽和度モニタリングの値が安定しておれば,15~60秒程度拡張を持続する5, 7).いったん狭窄が解除されたように見えても多くの病変はいくらかrecoilして狭窄するため,同一狭窄部で2回以上のinflationを行う5).その際はinflationごとにバルーン位置を確認すべきである.PTA後の操作は,ガイドワイヤを残してover the wireで行うことが原則である.ガイドワイヤを抜去した後,新たに入れ直して病変部を探ると,バルーン拡張後脆弱になっている病変部とその周辺部を損傷する危険性がある.PTA後の操作も含め,手順をよく検討しておくことが重要である.PTPVと同様,初回PTAの効果判定や血圧モニタリングの観点から,あらかじめもう1ヵ所の静脈アクセスの確保が勧められる5, 7).リアルタイムでの血圧観察が可能な観血的動脈圧モニタリングを行う7).15 mm以上の血管拡張径を確保する必要がある場合,ダブルバルーン法が施行されることが多い2).
多発性末梢肺動脈狭窄では,冠動脈のカテーテル治療領域ではよく知られた“kissing balloon technique”が有用なことがある7).すなわち,本幹のバルーン拡張により側枝近位部の狭窄をきたさぬよう,側枝にもバルーンカテーテルを挿入し本幹のバルーンと同時にinflationするというものである.同時にinflationしない場合でも,近接する各々の狭窄分枝にあらかじめガイドワイヤを挿入しておけば,一方のPTA後に他方をガイドワイヤで探り血管損傷をきたす危険性を回避できる(Fig. 4b, c).
鎮静については,年長児以上で単独狭窄の症例では全身麻酔は不要で鎮静のみで施行可能なことが多い7).効果機序の項で述べたように,PTA時には血管内膜から中膜に亀裂が生じ痛みの訴えがあるため,十分な鎮静を心がける.年少児や複数箇所の狭窄解除が必要で長時間に及ぶ症例,重症例では全身麻酔下に施行したほうが安全である7).
5. カッティングバルーン
通常のPTAで狭窄の解除が困難な症例では,カッティングバルーンの使用が考慮される2, 5, 7, 8).超高耐圧バルーンが使用可能となった現在では,使用される頻度は以前ほど高くはないが,術後の高度瘢痕性狭窄症例では有用である.使用するカッティングバルーン径は,参照血管の110%を超えないようにする7).現在使用できるカッティングバルーン径は2~6 mmと小さく,まずカッティングバルーンで血管壁に切れ目を入れ,その後高耐圧ないし超高耐圧バルーンで追加拡張する使い方をする(Fig. 5).
6. 治療成績と合併症/続発症
最狭窄部径の50%以上の拡張7),または圧較差の50%以上の減少を成功の定義とすることが一般的である2).他に患側肺への20%以上の血流増加や右室収縮期圧/大動脈収縮期圧比の20%以上の減少を成功の定義に加える考えもある39).定義により差は生じるものの成功率は50~60%とされてきた2, 8, 39, 40)が,これらは初期の症例も含んでいることが多い.高耐圧あるいは超高耐圧バルーンカテーテルが使用されるようになった現在では,成功率は70~80%と考えられている8).前述の各種症候群に伴う肺動脈狭窄に対するPTAの成功率は50%程度である8).PTA後の肺動脈狭窄再発率は,12~20%とされている7, 40).
PTAの有効性と合併症は表裏の関係であり,重度の肺動脈損傷を起こすことがある.術後病変では周囲組織の癒着により,血管外漏出の危険性は少ないが,心房壁や大動脈壁に癒着している部分が穿孔した場合には,大動脈–肺動脈交通等のため急激で重篤な循環障害をきたすことがある2).PTPV手技と同様に,硬いガイドワイヤが右房・右室を伸展し徐脈や期外収縮などの不整脈が誘発されることがある2).またPTA後の再潅流による肺水腫や肺出血41)にも注意が必要である.
肺動脈弁狭窄に対するPTPVと,肺動脈狭窄に対するPTAについて概説した.PTPV/PTAに代表されるバルーンカテーテルを用いた拡大術は,小児・先天性心疾患領域でも施行頻度が高く,重要な治療法である.本邦には現在2つのガイドラインがあるが,基本的に同一のエビデンスに基づき作成され,共通する部分が多い.まずはこれらのガイドラインを基に治療計画を立てるのがよい.バルーンカテーテルを用いた拡大術は,確立された治療法であると同時に,新しいバルーンカテーテルやデバイスの登場,外科手術の進歩に伴う臨床上の適応拡大など,今後も発展が見込まれる治療法でもある.「より安全で効果的な治療」を目指し,絶えず最新の知見を取り入れ,技術を高めるよう努めたい.
利益相反に関して
日本Pediatric Interventional Cardiology学会の定める利益相反に関する開示事項はありません.
引用文献References
1) 日本小児循環器学会,日本Pediatric Interventional Cardiology学会:先天性および小児期発症心疾患に対するカテーテル治療の適応ガイドライン(http://www.jpic-meeting.org/pdf/guideline_catheter.pdf)
2) 日本循環器学会.循環器病の診断と治療に関するガイドライン(2012–2013年度合同研究班報告):先天性心疾患,心臓大血管の構造的疾患(structural heart disease)に対するカテーテル治療のガイドライン(2014年版)(http://www.j-circ.or.jp/guideline/pdf/JCS2014_nakanishi_h.pdf)
3) Mullins CE: Balloon dilation procedures-general in Mullins CE (ed): Cardiac Catheterization in Congenital Heart Disease. Malden, Blackwell Futura, 2006, pp 410–429
4) Mullins CE: Pulmonary valve balloon dilation in Mullins CE (ed): Cardiac Catheterization in Congenital Heart Disease. Malden, Blackwell Futura, 2006, pp 430–440
5) Mullins CE: Dilation of branch pulmonary artery stenosis in Mullins CE (ed): Cardiac Catheterization in Congenital Heart Disease. Malden, Blackwell Futura, 2006, pp 441–453
6) Rao PS: Pulmonary valve stenosis in Sievert S, Qureshi SA, Wilson N, et al (ed): Percutaneous Interventions for Congenital Heart Disease. London, Informa Healthcare, 2007, pp 185–195
7) Latson L: Pulmonary artery stenosis in Sievert S, Qureshi SA, Wilson N, et al (ed): Percutaneous Interventions for Congenital Heart Disease. London, Informa Healthcare, 2007, pp 447–454
8) Prieto LR, Latson LA: Pulmonary stenosis in Allen HD, Shaddy RE, Penny DJ, et al (ed): Moss and Adams’ Heart Disease in Infants, Children, and Adolescents, 9th edition. Philadelphia, Lippincott Williams and Wilkins, 2016, pp 983–1007
9) Rao PS: Percutaneous balloon pulmonary valvuloplasty: State of the art. Catheter Cardiovasc Interv 2007; 69: 747–763
10) Gikonyo BM, Lucas RV, Edwards JE: Anatomic features of congenital pulmonary valvar stenosis. Pediatr Cardiol 1987; 8: 109–116
11) McCrindle BW: Independent predictors of long-term results after balloon pulmonary valvuloplasty. Valvuloplasty and Angioplasty of Congenital Anomalies (VACA) Registry Investigators. Circulation 1994; 89: 1751–1759
12) Grüntzig AR, Senning A, Siegenthaler WE: Nonoperative dilatation of coronary-artery stenosis: percutaneous transluminal coronary angioplasty. N Engl J Med 1979; 301: 61–68
13) Kan JS, White RI Jr., Mitchell SE, et al: Percutaneous balloon valvuloplasty: a new method for treating congenital pulmonary-valve stenosis. N Engl J Med 1982; 307: 540–542
14) Krabill KA, Wang Y, Einzig S, et al: Rest and exercise hemodynamics in pulmonary stenosis: Comparison of children and adults. Am J Cardiol 1985; 56: 360–365
15) Hayes CJ, Gersony WM, Driscoll DJ, et al: Second natural history study of congenital heart defects. Results of treatment of patients with pulmonary valvar stenosis. Circulation 1993; 87 Suppl: I28–I37
16) Rao PS: Balloon pulmonary valvuloplasty for isolated pulmonic stenosis. In: Rao PS (ed): Transcatheter Therapy in Pediatric Cardiology. New York: Wiley-Liss, 1993, pp 59–104
17) Ettedgui JA, Ho SY, Tynan M, et al: The pathology of balloon pulmonary valvoplasty. Int J Cardiol 1987; 16: 285–293
18) Medina A, Bethencourt A, Olalla E, et al: Intraoperative balloon valvuloplasty in pulmonary valve stenosis. Cardiovasc Intervent Radiol 1989; 12: 199–201
19) McCrindle BW, Kan JS: Long-term results after balloon pulmonary valvuloplasty. Circulation 1991; 83: 1915–1922
20) Rao PS, Galal O, Patnana M, et al: Results of three to 10 year follow up of balloon dilatation of the pulmonary valve. Heart 1998; 80: 591–595
21) Rao PS, Galal O, Wilson AD: Feasibility and effectiveness of repeated balloon dilatation of restenosed congenital obstructions after previous balloon valvuloplasty/angioplasty. Am Heart J 1996; 132: 403–407
22) Poon LK, Menahem S: Pulmonary regurgitation after percutaneous balloon valvoplasty for isolated pulmonary valvar stenosis in childhood. Cardiol Young 2003; 13: 444–450
23) Berman W Jr., Fripp RR, Raisher BD, et al: Significant pulmonary valve incompetence following oversize balloon pulmonary valveplasty in small infants: A long-term follow-up study. Catheter Cardiovasc Interv 1999; 48: 61–65
24) Harrild DM, Powell AJ, Tran TX, et al: Long-term pulmonary regurgitation following balloon valvuloplasty for pulmonary stenosis: Risk factors and relationship to exercise capacity and ventricular volume and function. J Am Coll Cardiol 2010; 55: 1041–1047
25) Thapar MK, Rao PS: Significance of infundibular obstruction following balloon valvuloplasty for valvar pulmonic stenosis. Am Heart J 1989; 118: 99–103
26) Stanger P, Cassidy SC, Girod DA, et al: Balloon pulmonary valvuloplasty: Results of the valvuloplasty and angioplasty of congenital anomalies registry. Am J Cardiol 1990; 65: 775–783
27) Al Kasab S, Ribeiro P, Al Zaibag M: Use of a double balloon technique for percutaneous balloon pulmonary valvotomy in adults. Br Heart J 1987; 58: 136–141
28) Ali Khan MA, Yousef SA, Mullins CE: Percutaneous transluminal balloon pulmonary valvuloplasty for the relief of pulmonary valve stenosis with special reference to double-balloon technique. Am Heart J 1986; 112: 158–166
29) Mullins CE, Nihill MR, Vick GW 3rd, et al: Double balloon technique for dilation of valvular or vessel stenosis in congenital and acquired heart disease. J Am Coll Cardiol 1987; 10: 107–114
30) Radtke W, Keane JF, Fellows KE, et al: Percutaneous balloon valvotomy of congenital pulmonary stenosis using oversized balloons. J Am Coll Cardiol 1986; 8: 909–915
31) Yeager SB: Balloon selection for double balloon valvotomy. J Am Coll Cardiol 1987; 9: 467–468
32) Rao PS: Influence of balloon size on short-term and long-term results of balloon pulmonary valvuloplasty. Tex Heart Inst J 1987; 14: 57–61
33) Narang R, Das G, Dev V, et al: Effect of the balloon-anulus ratio on the intermediate and follow-up results of pulmonary balloon valvuloplasty. Cardiology 1997; 88: 271–276
34) Trivedi KR, Benson LN: Interventional strategies in the management of peripheral pulmonary artery stenosis. J Interv Cardiol 2003; 16: 171–188
35) Gay BB, Franch RH, Shuford WH, et al: The roentenologic features of single and multiple coarctations of the pulmonary artery and branches. Am J Roentgenol Radium Ther Nucl Med 1963; 90: 599–613
36) Martin EC, Diamond NG, Casarella WJ: Percutaneous transluminal angioplasty in non-atheroscklerotic disease. Radiology 1980; 135: 27–33
37) Lock JE, Niemi T, Einzig S, et al: Transvenous angioplasty of experimental branch pulmonary artery stenosis in newborn lambs. Circulation 1981; 64: 886–893
38) Lock JE, Castaneda-Zuniga WR, Fuhrman BP, et al: Balloon dilation angioplasty of hypoplastic and stenotic pulmonary arteries. Circulation 1983; 67: 962–967
39) Rothman A, Perry SB, Keane JF, et al: Early results and follow-up of balloon angioplasty for branch pulmonary artery stenoses. J Am Coll Cardiol 1990; 15: 1109–1117
40) Hosking MC, Thomaidis C, Hamilton R, et al: Clinical impact of balloon angioplasty for branch pulmonary arterial stenosis. Am J Cardiol 1992; 69: 1467–1470
41) Feinstein JA, Goldhaber SZ, Lock JE, et al: Balloon pulmonary angioplasty for treatment of chronic thromboembolic pulmonary hypertension. Circulation 2001; 103: 10–13