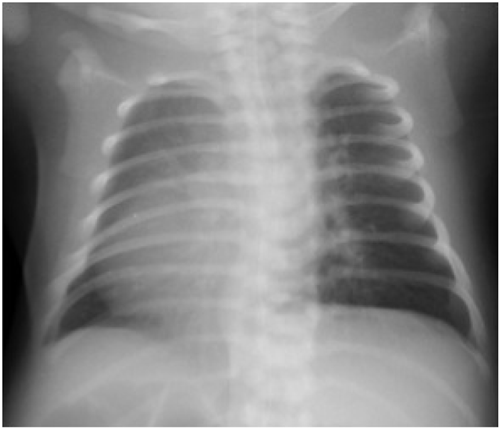
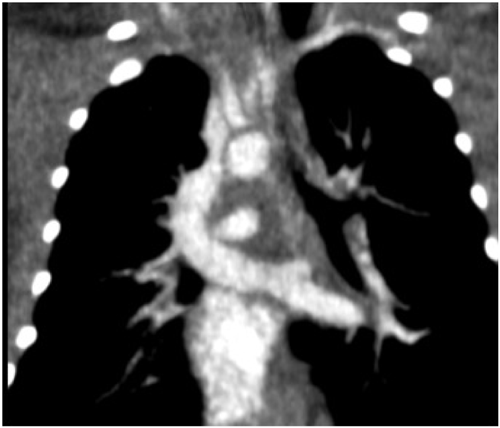
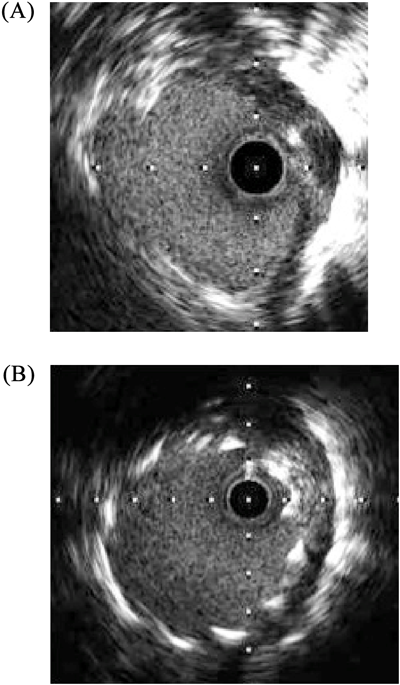
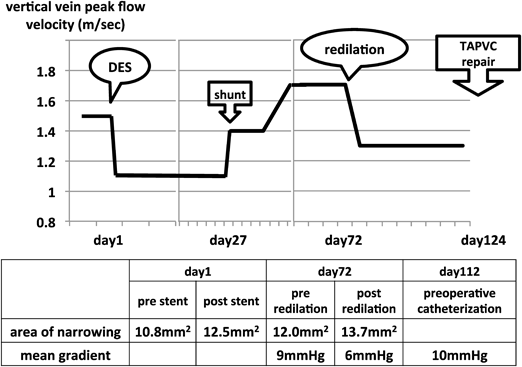
上心臓型総肺静脈還流異常症の垂直静脈狭窄に対し薬剤溶出性ステントを用い良好な開存を得られた右側相同の一例Drug Eluting Stent Implantation for Vertical Vein Stenosis in a Patient with Right Isomerism and Total Anomalous Pulmonary Venous Connection
1 東京大学医学部小児科Department of Pediatrics, University of Tokyo
2 国立成育医療研究センター循環器科Division of Cardiology, National Center for Child Health and Development
3 東京大学医学部心臓外科Department of Cardiovascular Surgery, University of Tokyo
4 東京大学医学部循環器内科Department of Cardiovascular Medicine, University of Tokyo