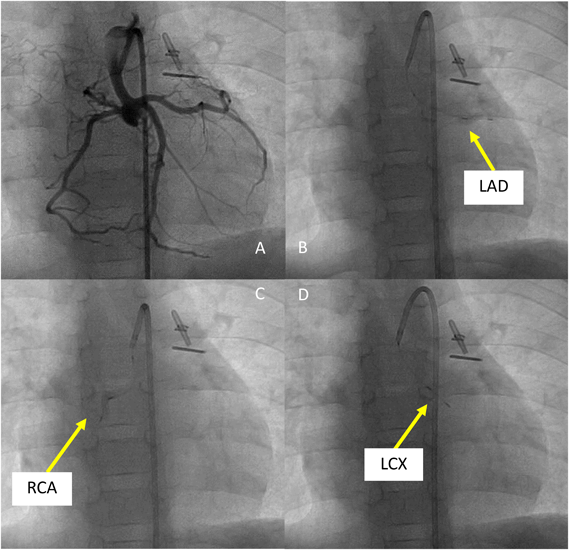
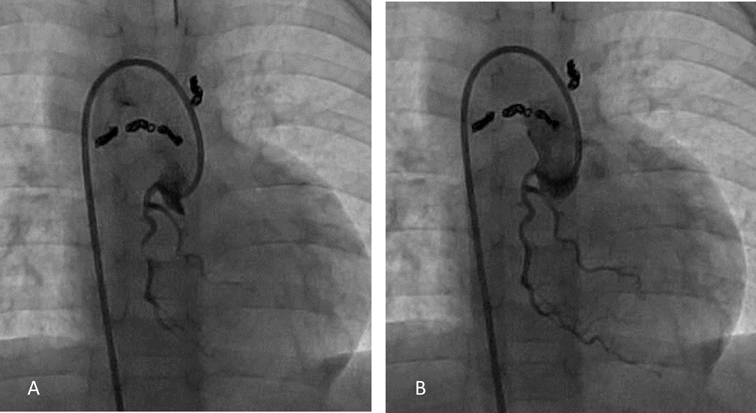
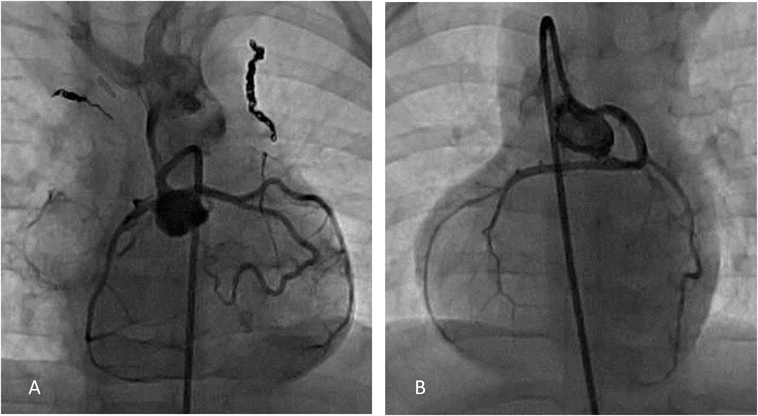
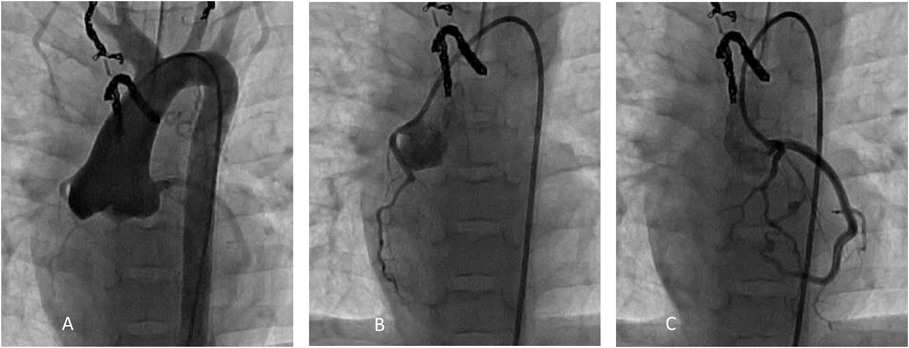
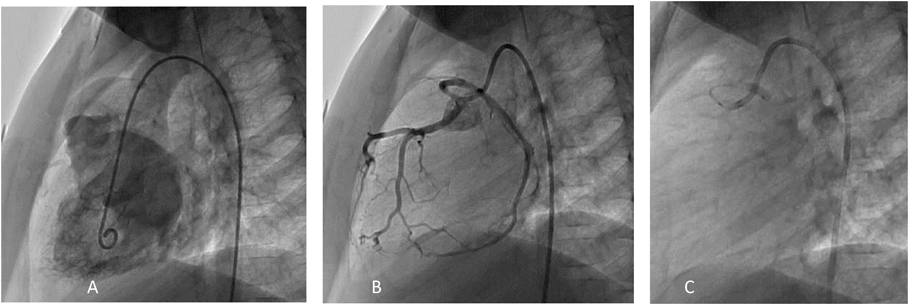
機能的単心室小児における冠動脈バルーン閉鎖下心筋幹細胞注入の実際Transcoronary Cardiac Progenitor Cell Infusion Using Stop Flow Technique in Children with Single Ventricle Physiology
1 岡山大学大学院医歯薬総合研究科小児医科学Department of Pediatrics, Okayama University Graduate school of Medicine, Density, and Pharmaceutical Sciences ◇ Okayama, Japan
2 岡山大学大学院医歯薬総合研究科小児循環器科Department of Pediatric Cardiology, Okayama University Graduate school of Medicine, Density, and Pharmaceutical Sciences ◇ Okayama, Japan
3 岡山大学大学院医歯薬総合研究科心臓血管外科Department of Cardiovascular Surgery, Okayama University Graduate school of Medicine, Density, and Pharmaceutical Sciences ◇ Okayama, Japan
4 岡山大学病院新医療研究開発センター再生医療部Department of Regenerative Medicine, Center for Innovative Clinical Medicine, Okayama University Hospital ◇ Okayama, Japan