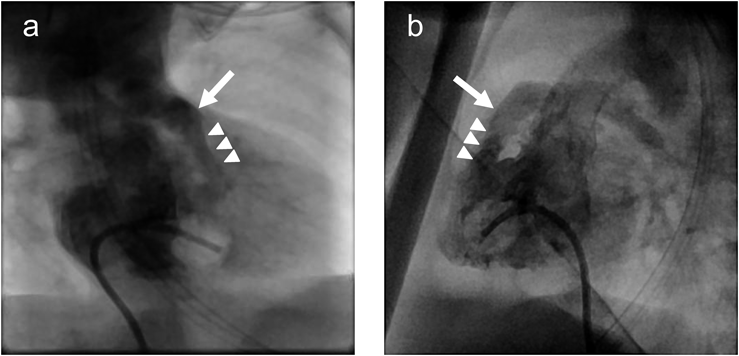
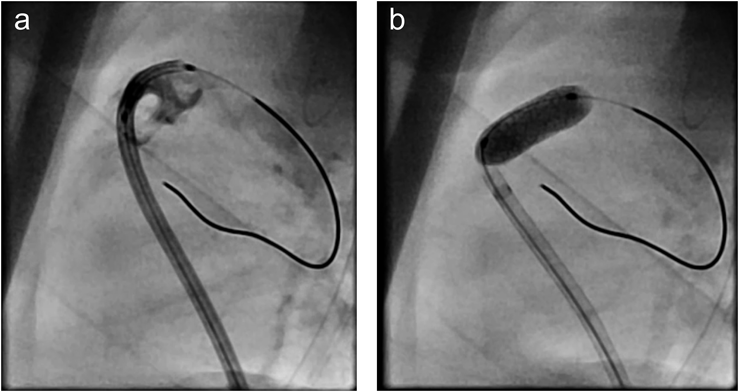
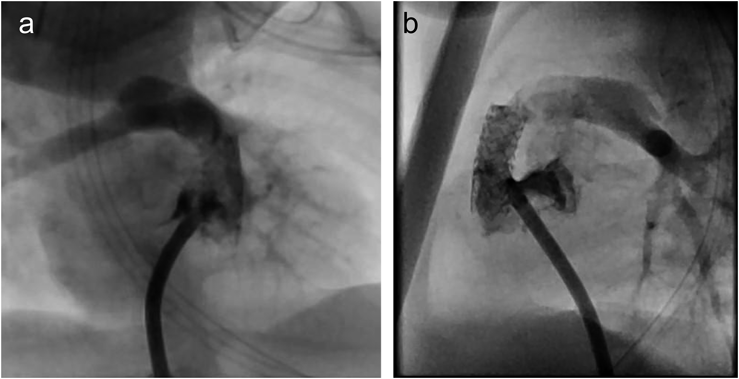
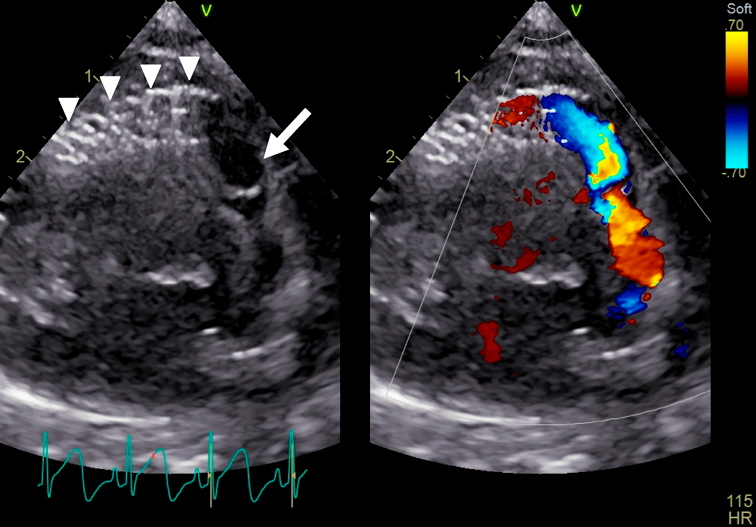
ファロー四徴症に対して右室流出路ステントを留置した18トリソミー症候群の乳児例Right ventricular outflow tract stenting in an infant with trisomy 18 and tetralogy of Fallot
1 日本赤十字社医療センター 小児科Japanese Red Cross Medical Center
2 国立成育医療研究センター 周産期・母性診療センター 新生児科National Center for Child Health and Development
3 日本赤十字社医療センター 新生児科Japanese Red Cross Medical Center