動脈管開存(patent ductus arteriosus;以下PDA)に対する閉鎖栓として,2009年のAmplatzer® Duct Occluder(Abbott, Santa Clara, CA),2019年のAmplatzer® Duct Occluder II(Abbott, Santa Clara, CA)に続き,2020年にAmplatzer Piccolo® Occluder(以下Piccoloと示す;Abbott, Santa Clara, CA)が国内に導入された.それぞれ安全な普及がすすみ,外科治療に代わり,幅広い年齢層と体格における第一選択の治療法として確立してきている.特にPiccoloは,米国で2017~2018年に実施された8施設50例の臨床試験での良好な成績1)を受けて2019年に米国で承認され,日本では,2019年に承認され,2020年4月に保険収載された.
Piccoloは,72本または144本の非常に細いニチノール合金のワイヤーを編み込んだ自己展開型の閉鎖栓であり,中心部のウエストの両端に同形状の保持ディスクを備えている.閉鎖する動脈管の直径および長さに合わせて9種類のサイズがあり,病変部に送達させるカテーテルシステムを含めて,従来のカテーテル閉鎖セット以上に極めて小径で柔軟性の高いものとなっている.添付文書,ならびに関連学会の制定した「適正使用に関する手引き」では,手技時生後3日以上,体重700 g以上,最小径4 mm以下,長径3 mm以上の動脈管が適応となっている2).正期産の新生児から年長児の細いPDAも対象となるが,基本的には低出生体重児の症候性PDAが最も有効性が高い対象として期待されている.
上述した米国の臨床試験では,低出生体重児においてはPDAを含めた全身の血管組織が脆弱であり,後述するように留置手技も異なってくることから,対象患者を体重「2 kg未満」と「2 kg以上」の2群に分けて評価されていた.本邦でも,いわゆるラーニングカーブを軽減するために,基準を満たした各施設において導入期に対象患者の体重を段階的に下げていくことが「適正使用に関する手引き」に定められている.当初は,手技時体重2~4 kgの症例を3例経験(ステップ1),手技時1~2 kgの症例を3例以上経験(ステップ2),その後手技時体重1 kg未満(ステップ3)へと進むことが要件とされた.(注:2021年12月より,ステップ1の体重要件2~6 kg,ステップ2の症例数要件2例以上に改訂)
今回当院において,ステップ2の症例を2例経験した.年長児例やステップ1とは異なる適応判定と留置手技の実例の紹介に,考察を加えて報告する.
(1) 現病歴
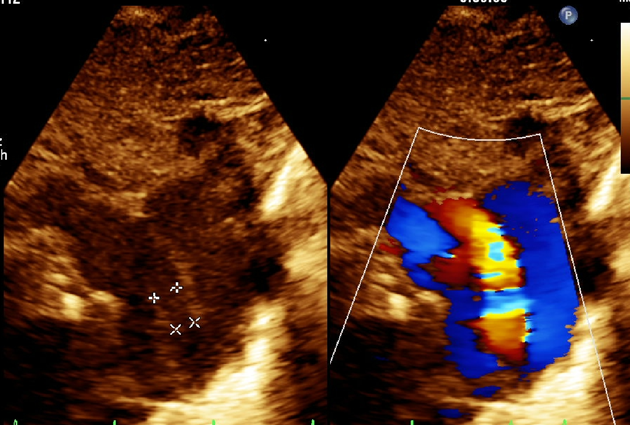
在胎27週4日,出生体重1090 g.子宮内感染(絨毛膜羊膜炎,Blanc stage 3)に伴う切迫早産のため緊急帝王切開で出生.呼吸障害のため生後4分に気管挿管,人工呼吸管理となった.人工呼吸管理後も酸素化障害が持続し,日齢1にサーファクタント投与,日齢9より症候性PDAに対して,イブプロフェン2クール,インドメタシン2クールを投与されたが奏功せず,心エコー上,肺動脈端2.0 mm,大動脈端1.6 mm,長径4.8 mmのF型3)PDAが残存した(Fig. 1).Infant Heart Team協議での結果,日齢18,体重1134 gでPiccoloによるPDA閉鎖術の方針となった.
(2) 手技
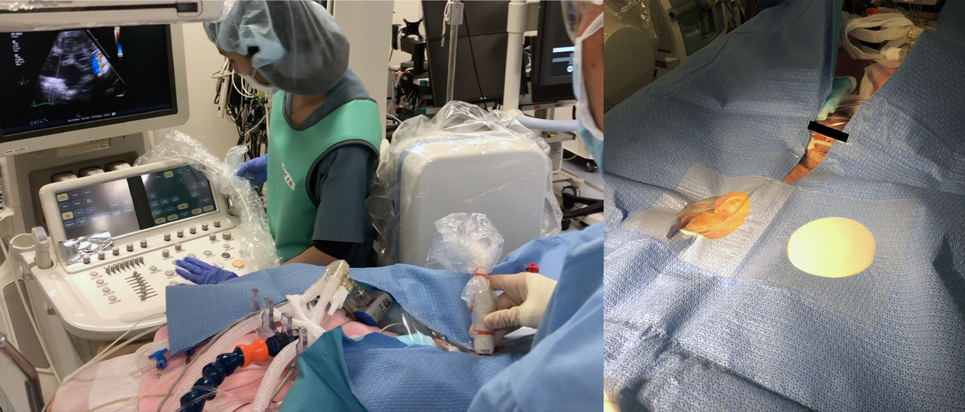
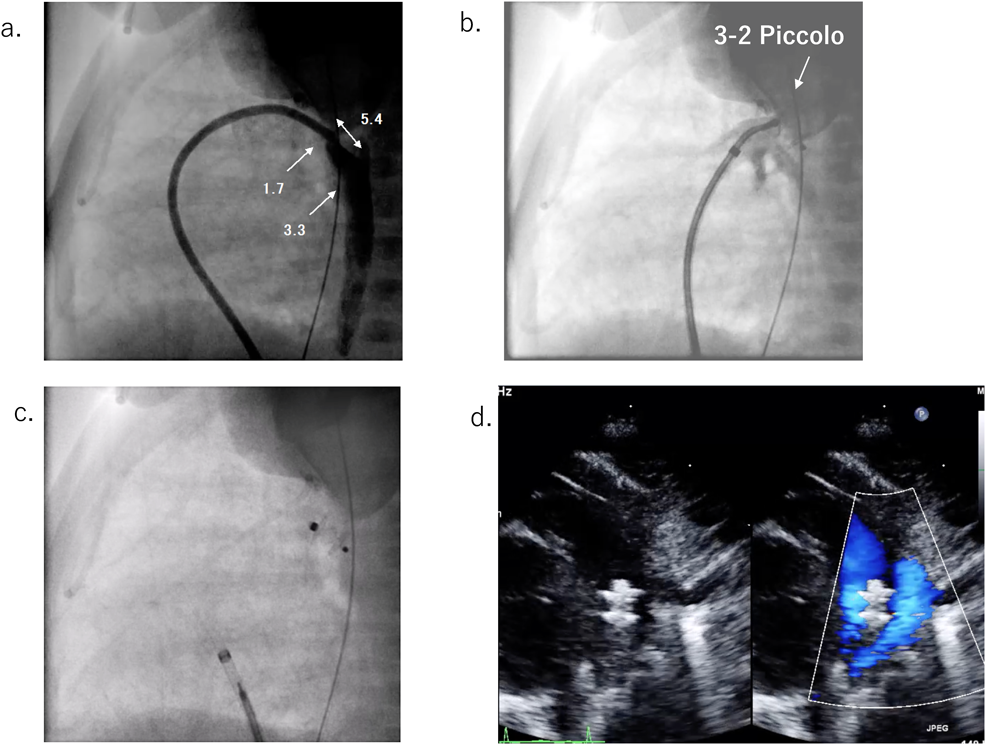
心カテ室内を27°Cに保ち新生児集中治療室からの保育器を搬入した.ドレープの頭側中央を細いU字型にカットし,透明なドレッシングテープで覆い,患児の頭部体幹皮膚色の可視化と,術野から経胸壁心エコーが行えるよう準備した(Fig. 2).エコーガイド下,2 mm径と計測された右大腿静脈に,22 G留置針と4 F Prelude IDEAL™(Merit Medical, South Jordan, UT, USA)シースに付属した0.018 inchガイドワイヤーの組み合わせで穿刺し,同シースを留置した.引き続き4 F Glidecath® II(non-taper angle, Terumo Corporation, Tokyo, Japan)と0.035 inch Silverway®(angle, ASAHI INTECC, Aichi, Japan)の組み合わせで,右室経由で主肺動脈,PDA,下行大動脈へ容易に到達した.Sliverwayを抜去したGlidecath先端から用手的に0.5 mLで造影し,肺動脈端1.7 mm,大動脈端3.3 mm,長径5.4 mmのF型PDAが確認された.Silverway越しに,4 F Amplatzer® TorqVue LPデリバリーカテーテルに交換した.3-2 Piccolo(9-PDAP-03-02-L)を選択し,透視側面像の経鼻胃管をランドマークとして,その前方の動脈管内に限局して展開した.カテーテル先端から0.5 mLの造影剤にて肺動脈側の確認,短時間に経胸壁心エコーで閉鎖栓の位置ならびに大動脈峡部・肺動脈分枝部血流に有意な狭窄が無いことを確認した(Fig. 3).引き続き閉鎖栓をリリースし,再度経胸壁心エコーと透視で確認し手技終了した.手技時間(シース留置から抜去まで)は39分,圧迫止血も良好であった.
(3) 術後経過
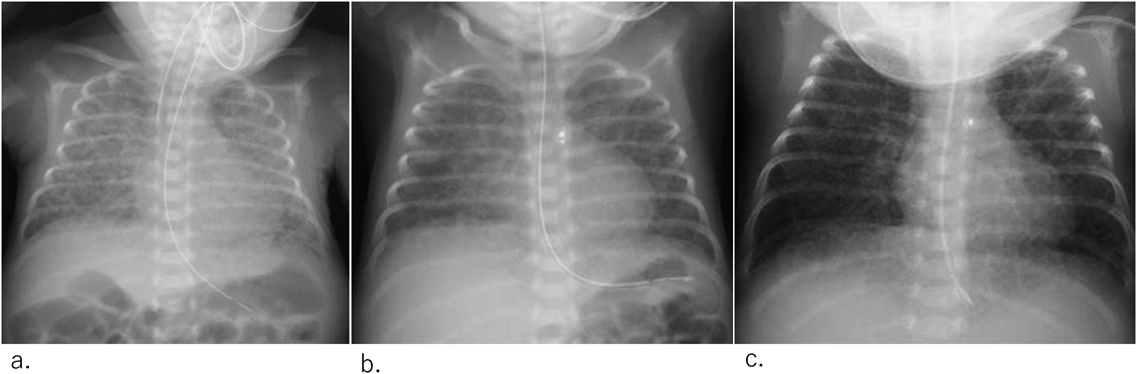
術翌日に循環作動薬持続静注終了した.子宮内感染に起因する重症慢性肺疾患に対して,呼吸管理を行い,日齢26に抜管し非侵襲的神経調節換気に移行した.日齢34までヒドロコルチゾン投与を行い,日齢67に経鼻的持続陽圧呼吸療法に変更した(Fig. 4).経腸栄養により約40g/日の体重増加が得られ,日齢71(修正37週5日),体重2230 gで地域の小児科に転院となった.
(1) 現病歴
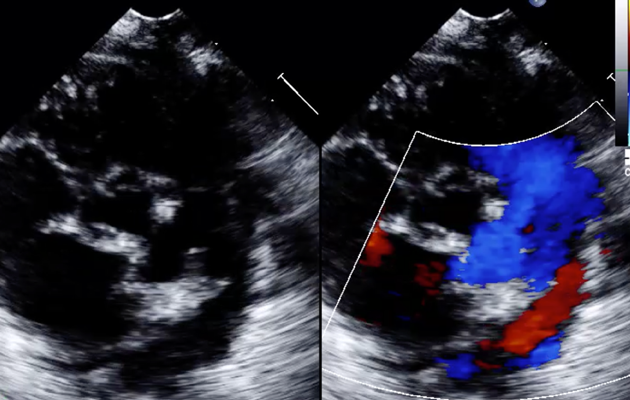
31週4日当院紹介受診し,胎児心エコーにて心筋肥厚,心嚢水,冠動脈の血流増加,大動脈拡張期逆流を認め入院管理となった.31週5日の胎児心拍数陣痛図にて基線再変動消失を認め同日緊急帝王切開となった.出生体重1614 g.出生後5分で気管挿管し,人工呼吸器管理を開始した.出生後顔貌などからDown症候群が疑われ,後日染色体検査で確定診断となった.新生児遷延性肺高血圧症があり,症候性PDAに対して日齢6からイブプロフェン2クール,インドメタシン2クール投与したが閉鎖傾向なく,日齢13に抜管した.心エコー上,肺動脈端2.4 mm,大動脈端3.2 mm,長径4.7 mmのF型PDA(Fig. 5)が残存した.PDAでは両方向性,心房中隔欠損の左右の短絡血流を認めた.Infant Heart Teamでの協議の結果,日齢15に体重1762 gでPiccoloによるPDA閉鎖術の方針となった.
(2) 手技
症例1と同様のカテーテル室内準備のもと,全身麻酔を導入した.右大腿静脈に4 F Prelude IDEAL™シースを留置し,4 F Glidecath® IIと0.035 inch Silverway®の組み合わせで,右室経由で主肺動脈,PDA,下行大動脈へ容易に到達した.
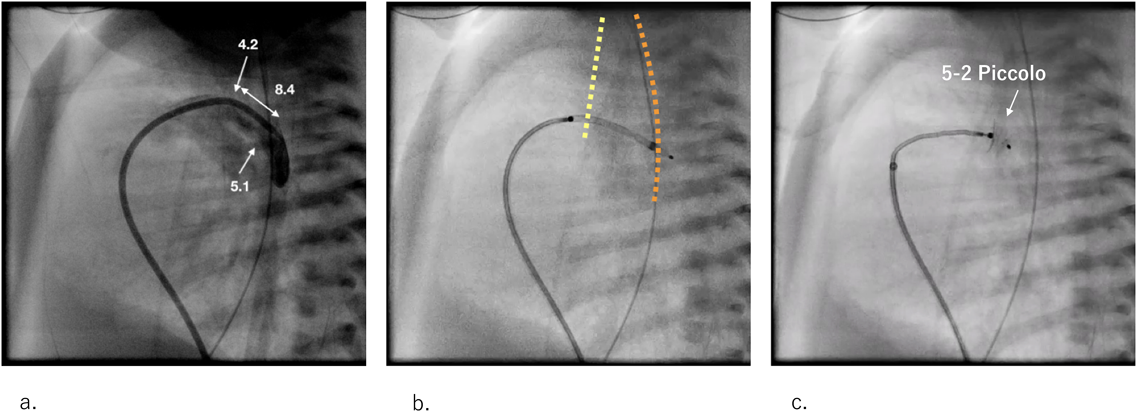
Glidecathを大動脈から肺動脈に引き抜きながら用手的に0.5 mLで造影したところ,心エコーの評価とは異なり肺動脈端4.2 mm,大動脈端5.1 mm,長径8.4 mmのC型PDAが確認された.造影直後に急激なSpO2低下,血圧低下が起こり肺高血圧症クライシス(PH crisis)と判断し,一酸化窒素(NO)吸入,静脈麻酔薬,ドパミン・ドブタミン持続点滴の増量,アドレナリン持続点滴の追加で改善を得て,全身状態が安定化した後にカテーテル手技を続行した.
Silverway越しに,4 F Amplatzer® TorqVue LPデリバリーカテーテルに交換した.5-2 Piccolo(9-PDAP-05-02-L)を選択し,透視側面像の経鼻胃管と上肢から上大静脈へ留置されたPIカテーテルをランドマークとして,動脈管内に限局して展開した.上方に開いた「Packmanサイン」(Fig. 6)を確認し,固定性が良好なためリリースした.初回造影でPH crisisをきたしたため留置後の確認造影は施行せず,短時間に経胸壁心エコーで閉鎖栓の位置ならびに大動脈峡部・肺動脈分岐部血流に有意な狭窄が無いことを確認し手技を終了した.手技時間(シース留置から抜去まで)は49分,圧迫止血も良好であった.
(3) 術後経過
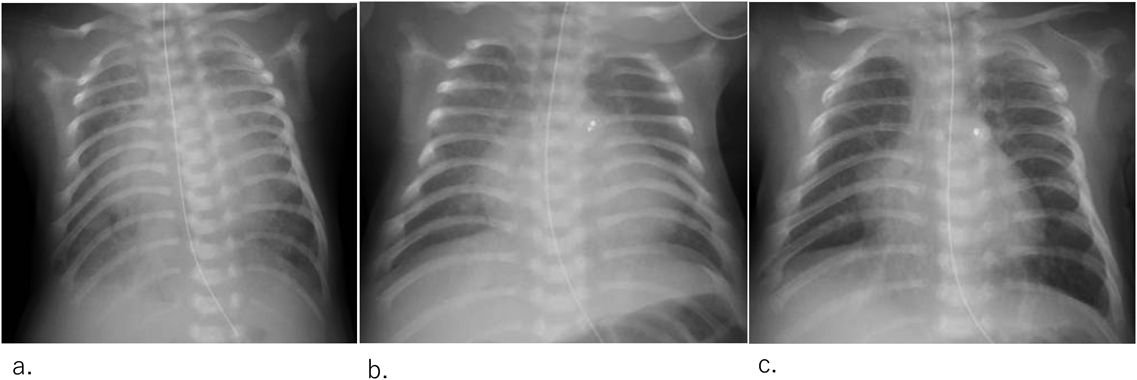
術翌日に循環作動薬持続静注終了し,術後2日にNO吸入も終了した.日齢22に抜管し,経鼻的持続陽圧呼吸療法へ移行し,日齢34から高流量鼻カヌラで呼吸管理を継続した(Fig. 7).肺高血圧に対して肺血管拡張薬のホスホジエステラーゼ5阻害剤を開始したが,肝機能障害のために中止した.体格に対し大きなPDAであったがPiccoloの脱落はなく,体重増加も良好に得られている.
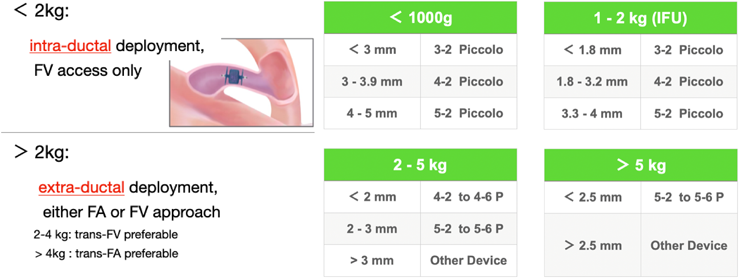
実臨床におけるPiccoloの適用方法や次に述べるサイズ選択については,国内導入時,使用に際して受講が要件とされたShyam Sathanandam医師による講義に基づいている1)(Fig. 8).
体重2 kg以上で症候性のPDAの場合,動脈管における血流量・血圧差に対する,Piccoloの形状や柔軟性から,突出よりも脱落の方が問題となりやすいこのため,留置時には肺動脈端と大動脈端の両方,もしくは,少なくとも肺動脈端で,保持ディスクを引っかける形での固定を原則とする(いわゆる動脈管外留置).手技時体重2-5 kgの患児では最小径3.0 mm以内,5 kg以上では最小径2.5 mm以内がPiccoloの適応限界の目安で,それ以上では脱落の危険性が高くなる.体重増加不良を伴う症候性の新生児・乳児の中には,この適合限界を超える大きさのPDAの割合が多い.その場合には他の閉鎖栓を適用するか,あるいは開胸手術を優先すべきと考えられる.
一方,体重2 kg未満の低出生体重児ではPDAにおける血流量や血圧差が小さく,形態的にはほぼ一貫してF型(胎児型)であるとされる.この形態の特徴として,長径10 mm以上で,肺動脈と大動脈間は離れており,大動脈から斜め上に上行し,やや水平となり肺動脈に接続する,ホッケー・スティックに似た形状となることが知られている3).このため,脱落の危険性は少なく,むしろ大動脈や肺動脈への突出を避けるため,PiccoloをPDAの斜上する内部に収める,いわゆる「動脈管内留置」が求められる.とくに体重1 kg未満の場合は最小径5 mmまでのPDAが閉鎖対象となりえる.
この体重2 kg以上,2 kg未満での対応の違いは,まさに「先天性心疾患としてのPDA」と「未熟性に伴うPDA」の違いといっても過言ではない.後者については,イブプロフェンやインドメタシンといったシクロオキシゲナーゼ阻害剤を含めた内科的治療不応性のものに対して,従来の開胸手術の代替としてPiccoloが位置付けられる.新生児領域の内科的管理も日進月歩であり,従来の開胸手術の成績も比較的良好とされていることから,小児循環器内科,小児心臓外科,新生児科を含むInfant Heart Teamにより,開胸手術を含めた治療方針・適応を慎重に判断することが重要となる.
今回提示した症例では,症例1はシクロオキシゲナーゼ阻害剤を中心とする管理により,直径・長径とも狭小化してきているF型PDAであり.循環動態への負荷はやや軽減がみられていたが,慢性肺疾患の長期管理も視野に入れ閉鎖術の適応となった.開胸手術では,肺損傷,感染,乳糜胸,反回神経麻痺,結紮術後症候群4)が一定の割合で合併する.そのためより低侵襲な治療としてのPiccoloが最適と考えられた.また症例2は基礎疾患としてDown症候群を合併した早産低出生体重児という「先天性心疾患としてのPDA」と「未熟性に伴うPDA」のどちらの要素も兼ね備えた症例であった.新生児遷延性肺高血圧症を合併しており,より低侵襲なPiccoloによるカテーテル治療を選択肢したことが非常に良好な術後経過を得ることにつながったと思われた.
これまで述べてきたように,PDA閉鎖栓の適切なサイズ選択のためには,PDAの正確な描出と計測が鍵となる.通常,計測値においては心エコー図と血管造影との相関は良好とされるが,低出生体重児PDAに習熟した施設においても過大評価,過小評価がありえるとの報告もある5).とくに症例2においては,肺動脈径計測が心エコーと造影で大きく異なる結果であり,後方視的に心エコー画像を検討したが,やはり造影の計測とは異なっていた.治療を要するPDAでは,高肺血流や慢性肺疾患のためしばしば肺障害があり鮮明なエコー画像が得られないことや,症例2のような両方向性シャントのPDAではカラードプラーでの動脈管径がわかりにくい点には留意すべきである.
また造影後にPH crisisをきたした点に関して,術前から肺高血圧が想定される患者の術中管理において,人工呼吸器管理を行う場合には,高いプラトー圧を避けるために,低換気量(5–7 mL/kg),低呼気終末圧設定,二酸化炭素貯留を避ける換気回数とすることが推奨されている.また昇圧剤としてはノルアドレナリン,少量バソプレッシンなどの血管収縮剤の使用が有用との報告もされている.PH crisisが発生してしまった場合には,速やかな昇圧,NO吸入などの肺血管拡張薬,十分な前負荷,後負荷の適正化が必要である6).今回の症例を通して,PH crisisは造影後やカテーテル操作時,閉鎖栓留置後などいつでも起こりえることを認識し,あらかじめPH crisisのリスクに関して,麻酔科医とよく事前に情報共有を行い,緊急時の対応を確認しておく必要があると考える.
体重1~2 kgの症例を2例経験し,安全かつ有効に治療を行うことができた.今後全国での低出生体重児PDAにおいても,慎重な適応判断と周術期管理,および手技の向上のもと,適応が拡大していくものと思われる.
引用文献References
1) Sathanandam SK, Gutfinger D, O’Brien L, et al: Amplatzer Piccolo Occluder clinical trial for percutaneous closure of the patent ductus arteriosus in patients ≥700 grams. Catheter Cardiovasc Interv 2020; 96: 1266–1276
2) 体重2.5 kg未満の動脈管開存症に対する経皮的動脈管閉鎖セット使用の適正使用に関する手引き(最終更新日2021年12月10日) http://www.jpic-meeting.org/cathe/piccolo.shtml
3) Philip R, Waller BR 3rd, Agrawal V, et al: Morphologic characterization of the patent ductus arteriosus in the premature infant and the choice of transcatheter occlusion device. Catheter Cardiovasc Interv 2016; 87: 310–317
4) Ulrich TJB, Hansen TP, Reid KJ, et al: Post-ligation cardiac syndrome is associated with increased morbidity in preterm infants. J Perinatol 2018; 38: 537–542
5) Paudel G, Johnson JN, Philip R, et al: Echocardiographic versus angiographic measurement of the patent ductus arteriosus in extremely low birth weight infants and the utility of echo guidance for transcatheter closure. J Am Soc Echocardiogr 2021; 34: 1086–1094
6) Price LC, Martinez G, Brame A, et al: Perioperative management of patients with pulmonary hypertension undergoing non-cardiothoracic, non-obstetric surgery: A systematic review and expert consensus statement. Br J Anaesth 2021; 126: 774–790