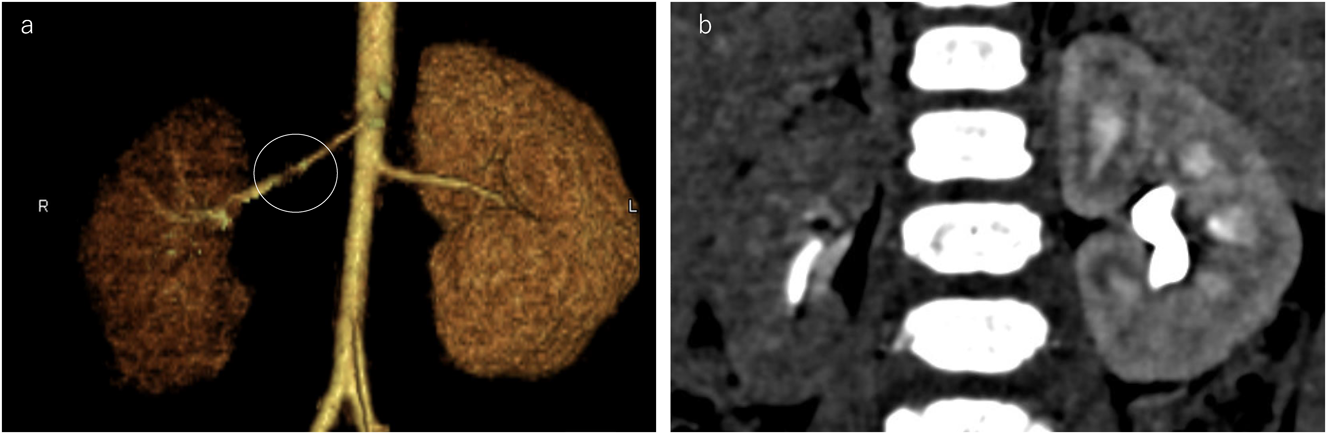
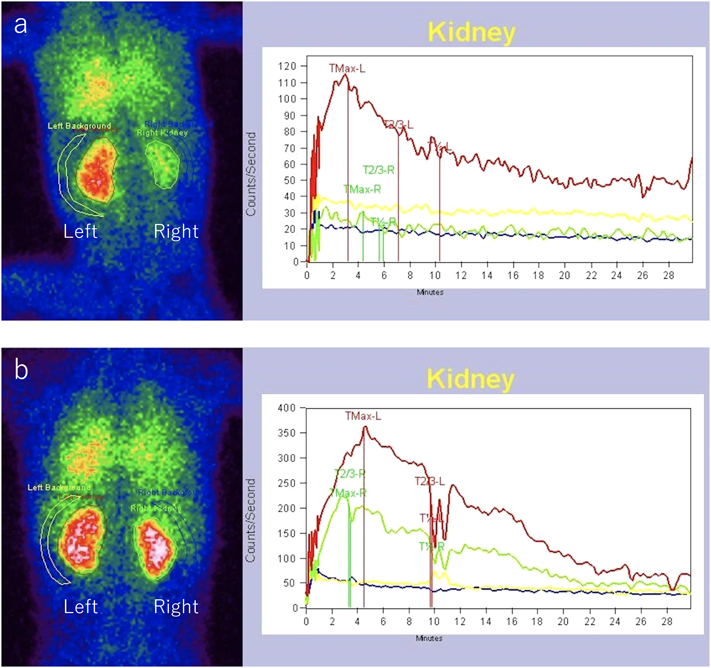
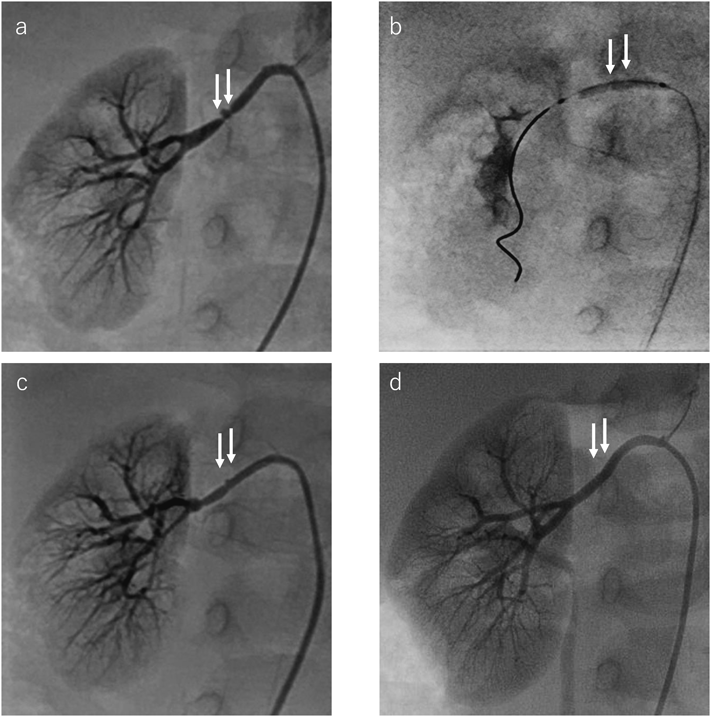
小児腎血管性高血圧における経皮的腎動脈形成術による患側腎のリバースリモデリングMorphological and functional reverse remodeling of the affected kidney after percutaneous transluminal angioplasty in a child with renovascular hypertension
1 昭和大学医学部小児科学講座Showa University School of Medicine, Department of Pediatric
2 昭和大学病院小児循環器・成人先天性心疾患センターPediatric Heart Disease and Adult Congenital Heart Disease Center, Showa University Hospital
3 東京衛生アドベンチスト病院小児科Tokyo Adventist Hospital,Department of Pediatric