総肺静脈還流異常症(Total Anomalous Pulmonary Venous Connection; TAPVC)は,1951年にMullerらが最初の外科治療を行って以来1),いくつもの術式の変遷を経てきた.現在では,術後の左右短絡を残さないために,多くの症例で術中に垂直静脈(Vertical vein; VV)を結紮している.しかし,TAPVCでは正常と比較し左房および左室が小さく,また拡張能も制限されている2–5).そのため,術前から肺静脈狭窄(Pulmonary venous obstruction; PVO)を認める症例においては,VVを結紮せずに一時的なreservoirとして残す事で,術後急性期の循環動態安定化を図る場合がある6).一方で,術後の残存VVに対する遠隔期の治療的介入の有無については定まったものはない.
今回,下心臓型TAPVCに対する根治手術後遠隔期の残存VVに対し,Amplatzer™ Vascular Plug II(AVPII; St. Jude Medical, Saint Paul, MN, USA)で塞栓術を行った成人例を経験した.下心臓型TAPVC術後の残存VVに対する経カテーテル的塞栓術の報告は少ないため,文献的考察も加えここに報告する.
26歳女性.下心臓型TAPVCの診断に対し,生後1ヶ月時に当院で心内修復術を行った.以降,当科外来に数年毎に通院していた.
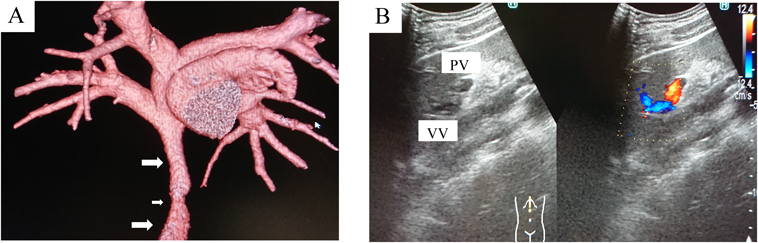
約3ヶ月前から,仕事中の動悸を自覚するようになった.24時間心電図検査の結果から房室結節接合部性頻拍が疑われ,カテーテルアブレーションを計画した.カテーテルアブレーションに先立って行った胸部造影CT検査で,肺静脈から門脈本幹に向かうVVを初めて指摘された(Fig. 1).CTでの計測上,VVは最狭部径6.2 mm,参照血管径8.7 mmであった.TAPVC根治手術の手術記録を確認したところ,心内修復後にpump offしたところ肺高血圧を認めたため,VVの結紮は行われていなかった.
当初の予定通り,カテーテルアブレーションを行った.カテーテルアブレーションの際に測定された肺体血流比(Qp/Qs)は1.33であった.術後経過良好で,一旦退院とした.VVを介した左右短絡量は多くないものの,患者自身が看護師として勤務しており,今後の仕事や妊娠・出産を考慮した上で,カテーテルによる閉鎖術を希望された.VVの走行および形態から,経皮的に塞栓術を行う事は可能であると考え,事前に書面での同意を得た上でAVPIIを用いた塞栓術を行う方針とした.
【入院時現症】
入院時身長:148.7 cm,体重:40.4 kg,体温:36.7°C,心拍数:86回/分,呼吸数:22回/分,血圧:122/63 mmHg,経皮的酸素飽和度(室内気):100%.
心音:リズム整,心雑音なし 肺野:清 末梢:温
【入院時検査所見】
血液検査:血算正常,肝・腎機能正常,電解質正常,CRP陰性,BNP 11.1 pg/mL
胸部X線:心胸郭比43%,肺血管陰影増強なし
心電図:心拍数75回/分,洞調律,QRS電気軸正常
【入院後経過】
入院4日目,全身麻酔下でVVに対する塞栓術を行った.術前の検討において,本症例では心房中隔穿通の必要性もある事から,まずは下大静脈から心房中隔穿通とVVへのアプローチを試みて,困難であれば上大静脈アプローチに切り替える方針とした.右大腿静脈から8 Frロングシース(SL0™, St. Jude Medical, Saint Paul, MN, USA)を挿入した.左大腿静脈に挿入した8 Frショートシースから心腔内エコー(AcuNav™, Biosense Webster, Inc., Diamond Bar, CA, USA)を進め,心腔内エコーのガイド下にBrockenbrough法による心房中隔穿通を行った.SL0™から高周波(RF)ニードルを進め,心腔内エコーで心房中隔を描出しつつ,RFニードルのtentingを確認し通電した.心房中隔壁が厚かったものの,0.035インチ ラジフォーカスワイヤー®(Terumo Inc., Tokyo)が左上肺静脈まで入った事を確認し,通電成功と判断した.ロングシースを8 Fr Super Arrow Flex®(Teleflex Inc., Morrisville, NC, USA)に入れ替え,シースごと左房内に進めた.
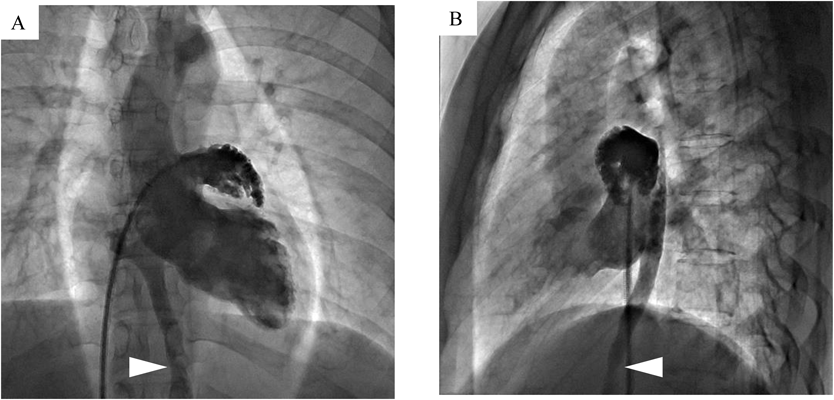
ここで左房造影を行ったところ,VVは椎体のほぼ中央,左房後方から下行していた(Fig. 2).垂直静脈径を測定したところ,最狭部径8.9 mm,参照血管径9.3 mmであり,造影CTで計測されたものよりも径が大きかった.VVへのアプローチとして,まず7 Fr Bermanカテーテルと0.035インチ ラジフォーカスガイドワイヤー®でアプローチを試みるも,右房からVVへの進入角度が急峻であり挿入できなかった.次に,先端回転型スプリングワイヤー(デフレクティングガイドワイヤー)を使用するも,同様の理由でやはりVVに挿入できなかった.そこで,ジャドキンス型左冠動脈用(JL)カテーテル®(Hanako Medical Co., Ltd., Saitama)に変更したところ,JLカテーテルと0.035インチ ラジフォーカス®でVVに到達しえた.JLをVV内まで進め,ワイヤーをAmplatz Super Stiff™(Boston Scientific, Marlborough, MA, USA)に入れ替えようとしたが,急峻なカテーテルの走行に対しワイヤーが追従せず,スプリングガイドワイヤー®(Togo Medikit Co., Ltd., Miyazaki)に変更したところ,ワイヤーをVV内に進める事ができた.JLを抜去し,Super Arrow Flex®をスプリングガイドワイヤー®に被せてVV内に進めた.
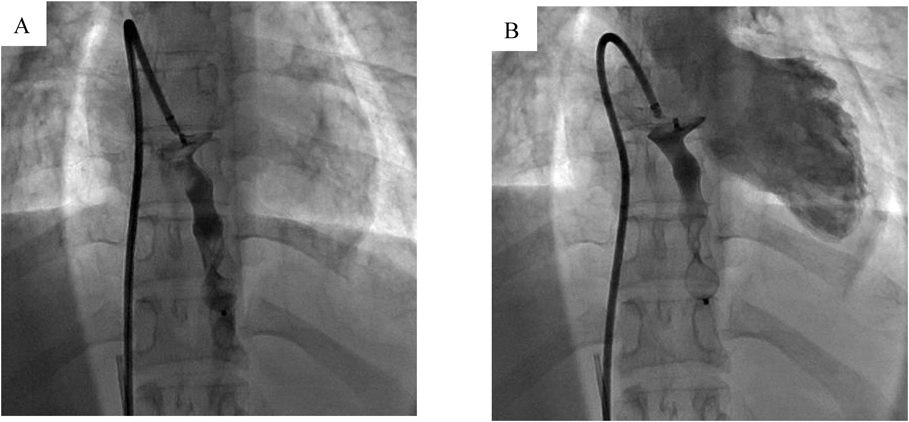
AVPIIの留置に際しては,対象血管が静脈である事および,有意な狭窄部がなく走行も長い事から,デバイスのmigration予防と十分な閉塞距離の確保が重要であると考えた.そのため,最小血管径の200%超のサイズのデバイスを留置すべきと考え,AVPII 20 mm×16 mmを選択した.Super Arrow Flex®をVVの横隔膜レベルに留置した状態でAVPIIを進めたが,途中で抵抗とともにAVPIIが進まなくなった.シースが急峻な角度を呈していた事から,AVPIIを通すにはよりシースの角度を緩やかにし,かつしっかり固定された方が容易であると考え,6 Fr Parent Plus™(Togo Medikit Co., Ltd., Miyazaki)に入れ替え同様の手技を試みた.Parent Plus™を横隔膜下レベルに留置した状態でAVPIIを進めたところ,問題なくシース先端まで進める事ができた.ロングシースを引きながらAVPIIを留置した.しかし,離脱前の造影でAVPIIの位置がやや浅く,デバイス近位部が左房内に突出している事が懸念された事から,一旦AVPIIをシース内に収納し,再度留置した.この時,ロングシースは引きすぎず,AVPIIを押し出すような形で留置したところ,適切な位置にAVPIIが留置された.離脱前に,再度ロングシースから造影を行い,少量の造影剤のleakは残るもののデバイス近位部はVVの入口部付近にあり,適切な位置であると判断した(Fig. 3A).AVPIIを離脱し,再度ロングシースから造影を行った.離脱後のデバイス位置は適切で,この時点で造影剤もleakも消失しており,完全閉塞を確認した(Fig. 3B).離脱前後での肺動脈圧は,それぞれ17/4(10)mmHgと18/8(12)mmHgであり,VV塞栓に伴う肺動脈圧の変化は認めなかった.
閉鎖術後から,抗血小板薬(チクロピジン)の内服を開始した.術後1日目に行った胸部X線検査および経胸壁心エコー図検査では,デバイスの位置に問題なく,左房内への突出は認めなかった.術後2日目,全身状態に著変なく退院とした.退院後は,上室頻拍の再燃もなく経過良好である.
TAPVCに対する根治手術の際に,VVを結紮せずに一時的なreservoirとして残す事で,術後急性期の循環動態安定化を図る場合がある.Copeらは,VVを結紮した症例と結紮せずに残した症例を後方視的に比較し,特に左房が小さい症例や術前からPVOを認めた症例ではVVを残す事が予後の改善につながる事を示した6).同様に,Chowdhuryらも症例に応じてVVを残す事が,術後の予後改善につながると述べている7).術後の残存VVに対する治療的介入の有無については,その後のVVの自然閉鎖の有無による.上心臓型や傍心臓型TAPVCにおいては,VVの自然閉鎖を認めない事も多く,その場合には左右短絡量に応じて外科的ないし経カテーテル的に閉鎖する事が推奨されており8–10),上心臓型TAPVCに対する経カテーテル的塞栓術については,これまでにいくつかの報告がある11, 12).一方,下心臓型TAPVCにおいては,肝血管床における高い血管抵抗により垂直静脈の血流量が制限されるため,残存VVのほとんどが自然閉鎖すると言われている13).そのため,下心臓型TAPVC術後の残存VVに対する経カテーテル的塞栓術としては,Kobayashiらが術後急性期にAmplatzer Vasucular Plug 1とGianturco coilを用いて閉鎖した新生児例を報告している14)が,術後遠隔期に残存VVに対する塞栓術を行った報告はない.
VVへのアプローチ方法として,本症例ではJLカテーテルにて比較的容易にVVに挿入できた事から,まずはカテーテルの形状が重要であると思われた.標的血管への走行をイメージし,予めその形状に合ったカテーテルを選択する事が肝要であり,手技時間の短縮にもつながる.また,事前にshapingを行ってもSuper Stiff™は通過しなかった事から,本症例のように進入角度が急峻な症例ではSuper Stiff™は不適であると考えられる.急峻な角度に対してデバイスを進める上で,ロングシースは十分な内径と硬さを有するものが望ましく,その点においてParent Plus™は本症例においては有用であった.
今回の症例では,術後遠隔期の胸部造影CTにて偶然に残存VVが見つかった.Qp/Qsは1.33であり,左右短絡量からは閉鎖術の絶対的な適応ではなかった.しかし,患者自身の仕事や将来的な妊娠・出産などのイベントを考慮した場合に,左右短絡量が増加する前に閉鎖術を受けたいという希望を踏まえ,今回閉鎖術を実施した.今回の症例は,AVPIIがVVのような太く長い距離を有する異常血管に対しても,安全に使用できる事を示した.特に下心臓型総肺静脈還流異常症でのVVの特徴として,胸腔内から横隔膜を通して腹腔内を通り門脈系に至るため,他の塞栓血管と比較し長い距離を走行する.そのため,本症例のようなケースにおいては,術後のデバイスmigrationのリスクなど長期的な経過観察を慎重に行っていく必要があると思われる.本症例は心房内の閉鎖栓であるため,経皮的心房中隔欠損閉鎖術の術後フォローに準じて経過観察を行っていく.チクロピジンは6ヶ月間継続とし,外来フォローは,術後1ヶ月,3ヶ月,6ヶ月,12ヶ月,以降は1年毎に行う予定である.
今回の症例で使用したAVPIIは,サイズが3 mm~22 mmまで選択可能であり,デバイスのボディが3面で血管壁に圧着し確実な塞栓が期待できる事から,大きなサイズの血管に対しても効率的な閉鎖が可能である.また,離脱直前まで造影が可能であるため,離脱前にデバイスの位置を微調整する事が可能である.塞栓術を行う際のAVPIIのサイズ選択については,動脈系においては血管径の130%~150%サイズを選択し,また静脈系においては150%サイズ選択が推奨されているが,文献上は動脈系においても血管径の175~200%サイズを推奨するものもある15).今回の症例においては,静脈系かつ長い距離を走行するVVに対する塞栓術であったため,十分なサイズと距離を確保する事で確実に塞栓を行う事を目指し,最小血管径の200%超サイズのデバイスを選択した.しかし,実際の手技においては留置時に対象血管が十分に拡張せず,AVPIIが想定よりも伸長した印象がある.これは,TAPVC術後に周辺組織に癒着が生じていた事による可能性もある.そのため,ワンサイズ小さいAVPII 18 mm×14 mm(血管径の約200%)の方がより余裕をもって留置でき,左房内への突出の懸念も少なかった可能性はある.実際のデバイスサイズの選択においては,血管径のみならず血管の形態や狭窄の程度,走行のしかたなどを総合的に評価した上で,各症例に応じた選択を行う事が肝要であると思われる.今回の手技において,術前はロングシースを横隔膜レベルよりも深い位置まで進め,AVPIIを留置する予定であった.しかし,実際にはロングシースを横隔膜レベルまでしか進める事ができなかったため,想定よりも手前からAVPIIを留置する事となった.そのため,留置の際にはロングシースは引かずに,AVPIIを押し出すように留置する事で,左房に突出しない位置に留置できた.閉鎖術後の心エコー図検査でも,デバイスの位置に特に問題はなく,適切な位置に留置されていた.留置の際には,デバイスがどのような形でどの程度の距離をもって留置されるか,事前に可能な限りイメージする事が重要であると改めて認識させられた.
最後に,本症例では術後遠隔期の胸部造影CTにて初めて残存VVが指摘された.当時の手術記録にはVVを結紮していない事が記載されていた事から,チーム内での患者情報の共有が不十分であった点が反省点として挙げられる.今回の症例を契機に,チーム内で改めて過去の成人先天性心疾患患者の手術情報を共有する方針である.