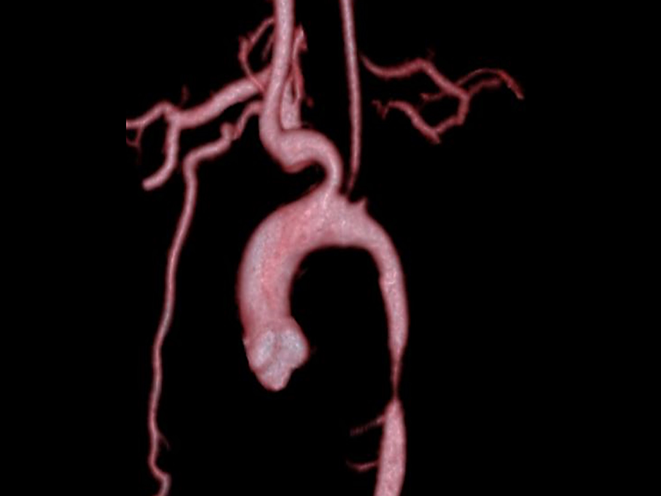
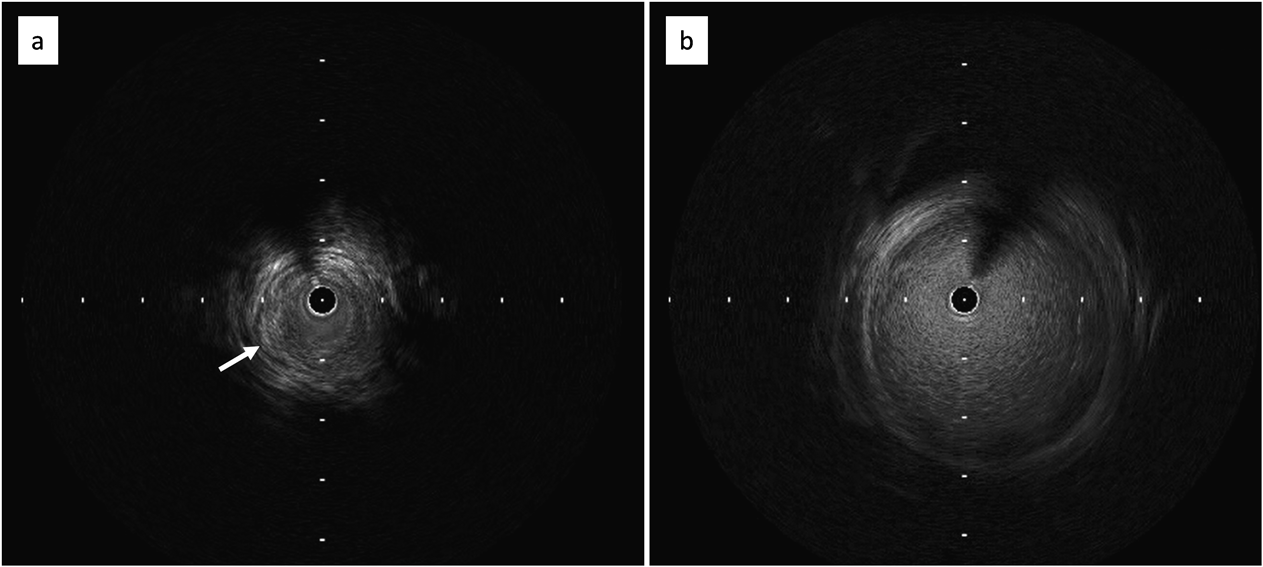
3か月男児の異型大動脈縮窄に対するステント留置—ミディアムサイズステントにおけるステントリマウント手技の効果—Stent implantation for atypical coarctation of the aorta in a 3 months old infant:Remount procedure of a medium size stent for downsizing of delivery profile
昭和大学病院小児循環器・成人先天性心疾患センターPediatric Heart Disease and Adult Congenital Heart Disease Center, Showa University Hospital ◇ Tokyo, Japan