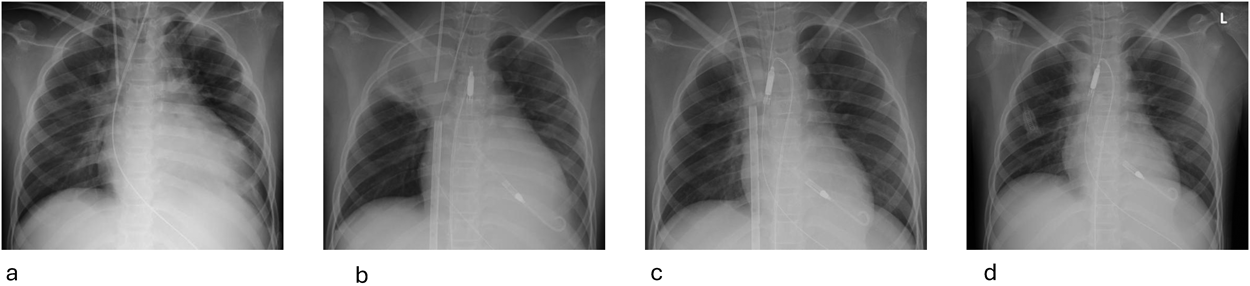
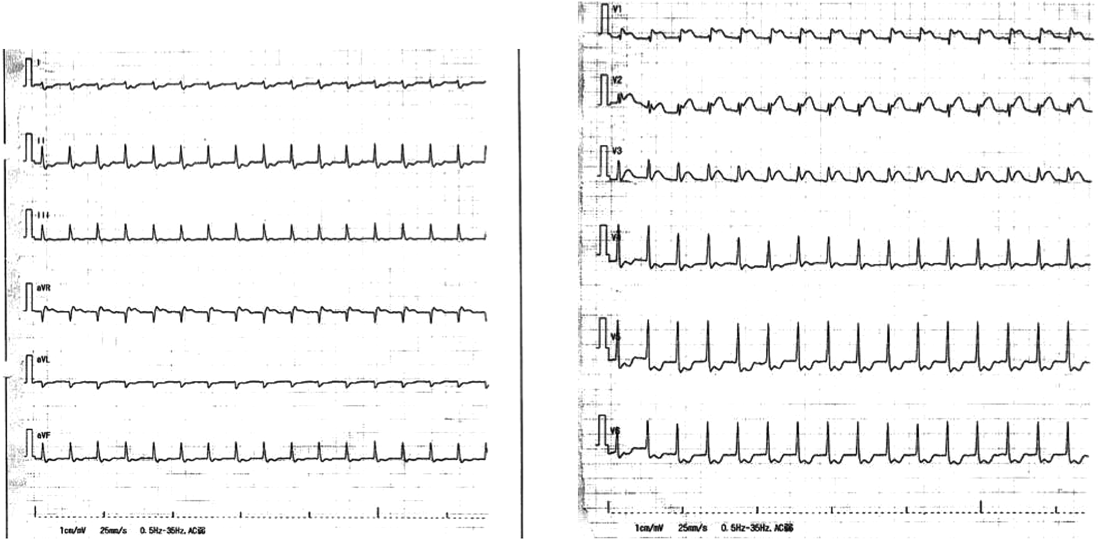
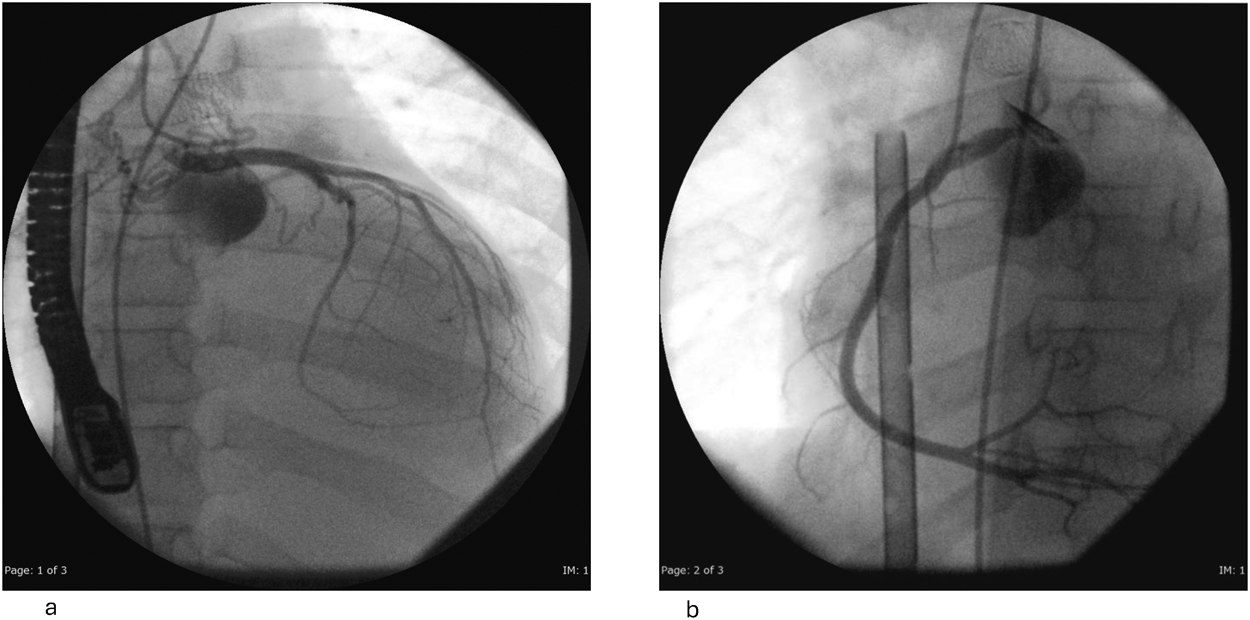
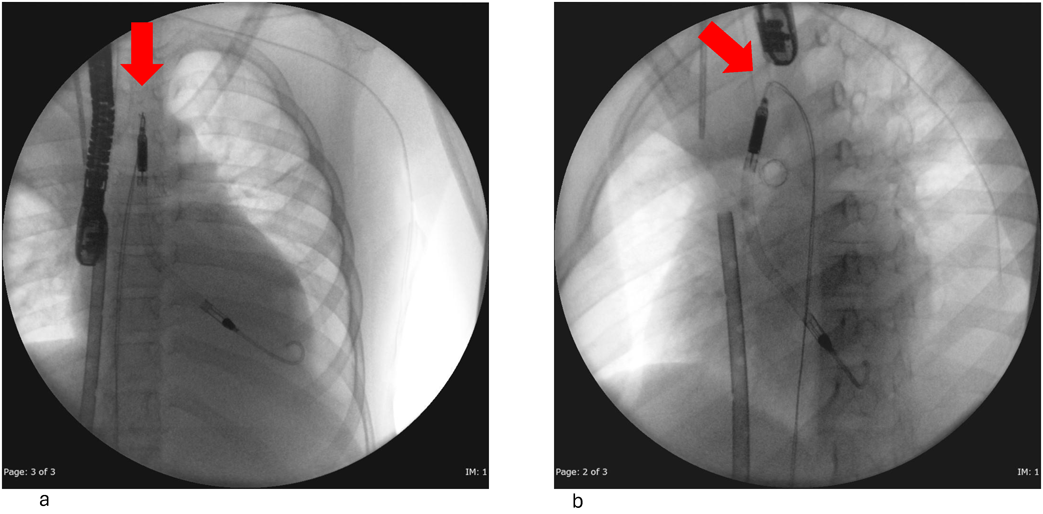
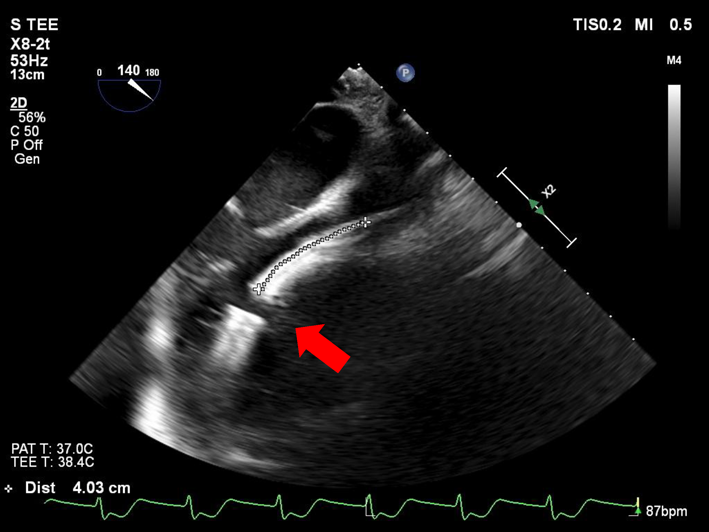
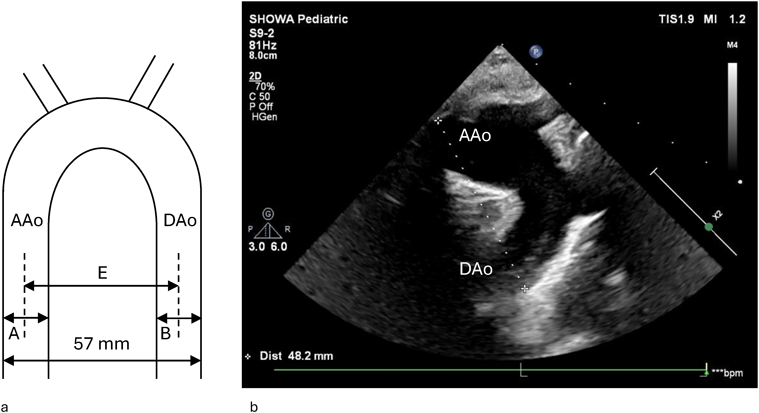
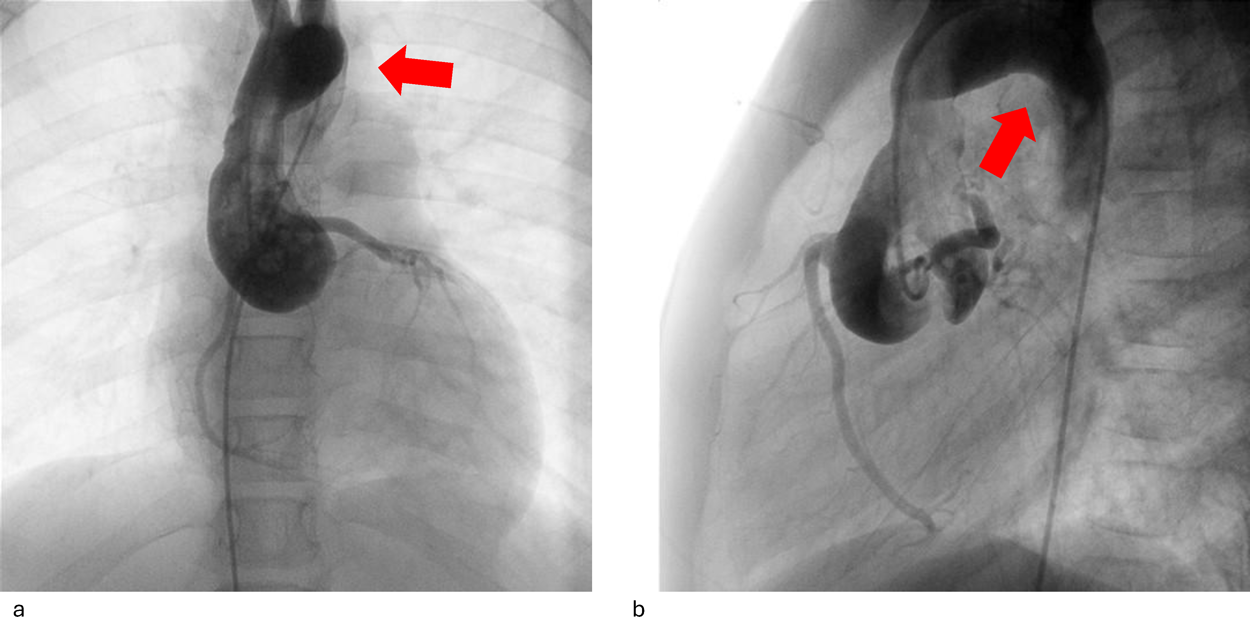
Impella®循環補助用心内留置型ポンプカテーテル(Impella® CP)と静動脈型体外式膜型人工肺により劇症型心筋炎の左室unloadingが著効した12歳男子例—体格の小さい患者における管理上の注意点A 12-year-old male case of successful left ventricular unloading utilizing Impella CP® and veno-arterial extracorporeal membrane oxygenation due to fulminant myocarditis—Precautions for management in patients with small stature
1 昭和医科大学病院小児循環器・成人先天性心疾患センターPediatric Heart Disease and Adult Congenital Heart Disease Center, SHOWA Medical University Hospital
2 昭和医科大学病院循環器内科Department of Cardiology, SHOWA Medical University Hospital