動脈管開存症(patent ductus arteriosus: PDA)は,胎児循環において大動脈と肺動脈を連結する血管が残存する疾患であり,その動脈管は,出生後には酸素分圧の上昇やプロスタグランジン濃度の低下により自然閉鎖するのが一般的である1).しかし,閉鎖しない場合,左→右シャントにより肺血流量の増加と左心系への容量負荷が生じ,心拡大や心不全を引き起こす原因となる1).PDAは早産児に多く,出生体重が小さいほど自然閉鎖率が低くなる1).満期産児でも,自然閉鎖せず1歳以降まで残存する割合は0.02~0.04 %程度とされている1).無症候性の小短絡のPDAであっても,長期的には左室容量負荷の持続により心腔拡大,心不全,肺高血圧の進行といった影響を及ぼす可能性がある.1977年にRashkindらが経カテーテル的閉鎖術を報告して以来2),非侵襲的な治療法としてPDA閉鎖は大きく進歩した.2000年代にはAmplatzer™ Duct Occluder〔ADO;(Abbott Cardiovascular, MN, USA)〕などのデバイスが登場し,小児の標準治療として広く用いられるようになった3).経カテーテル閉鎖術を受けた患者が,成人後に再介入を要する症例は極めて限られている.今回,乳児期にRashkind occlusion deviceによるPDA閉鎖術を受けた患者が,約30年後の成人期に残存シャントが増悪し,Amplatzer™ Duct Occluder II〔以下ADOII;(Abbott Cardiovascular, MN, USA)〕を用いて再閉鎖を行った稀な一例を報告する.
症例は35歳男性.出生時体重2832 g,在胎週数40週で経腟分娩で出生した.新生児期に心雑音を指摘され,心エコー検査にてPDAを認めた.肺血流増加を伴う左→右シャントがあり,生後11か月時に12 mm Rashkind occlusion deviceを用いた経カテーテル的閉鎖術が施行された.術後は軽度の残存シャントが認められたが,症状はみられず,小児循環器外来にて経過観察が継続された.学童期は特に症状なく経過し,定期的なフォローアップが行われた.中高時代は運動部に所属していたが労作時息切れや失神などの症状はみられず,成人期も就業のうえ日常生活に支障はなかった.既往歴には特記すべき疾患や手術歴,感染性心内膜炎の既往もなく,家族歴にも先天性心疾患は認められなかった.喫煙歴・飲酒歴もなかった.32年目の定期心エコー検査で,左室拡張末期径(Left Ventricular End Diastolic Diameter: LVEDD)が57 mm(114% of Normal)とこれまでの52 mm(104% of Normal)~54 mm(108% of Normal)と比較して拡大傾向を認めた.
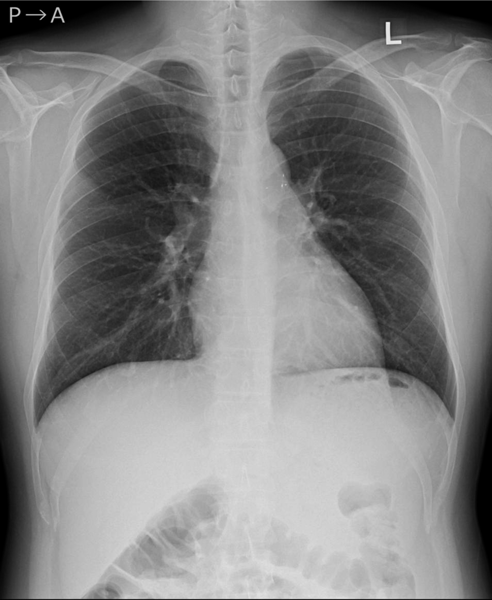
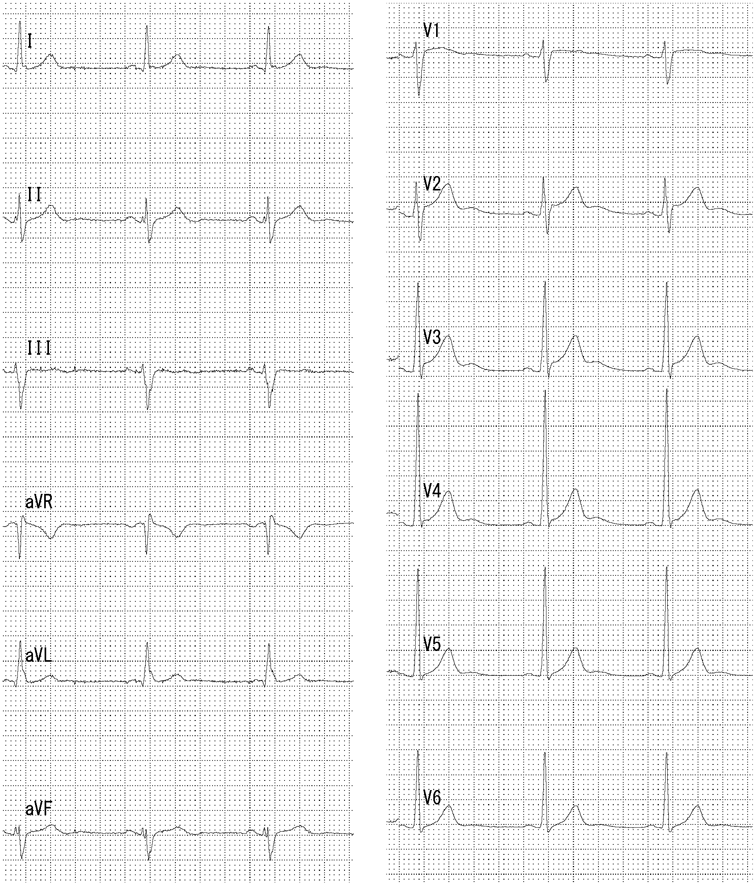
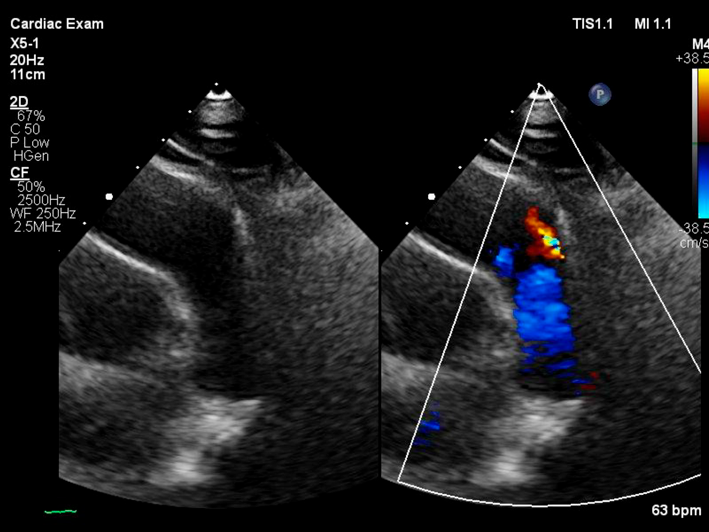
左→右短絡によるQp/Qsは1.2と推定され,心臓カテーテル検査の方針となった.身長168.6 cm,体重71.8 kg,血圧120/66 mmHg,脈拍数76回/分,経皮的酸素飽和度97%,浮腫なし,心拍整,第二肋間胸骨左縁Levine I/VI continuous murmur, bounding pulseなし,呼吸音清,腹部平坦軟,肝脾触知しない.入院時の胸部X線では心胸郭比(CTR : cardio thoracic ratio)47%と心拡大は軽度で,肺血管陰影の増強を認めなかった(Fig. 1).12誘導心電図は洞調律で心拍数60回/分,QRS軸-30°,有意な異常所見は認めなかった(Fig. 2).血液検査では,白血球9,700/µL, AST 28 U/L, ALT 36 U/L, NT-proBNP< 10 pg/mL, LDH 206 U/L, CPK 86 U/Lであった(Table 1).心エコー検査では肺動脈内連続性短絡血流があり(Fig. 3),収縮期max vel=3.7 m/sec拡張期max vel=2.9 m/secであった.また,軽度の僧帽弁逆流を認めた.左室駆出分画73%,左室流入波形(E/A=2.2 E/E′=6.9)と左室機能は保たれていた.明らかな下行大動脈の拡張期逆行性血流は認めなかった.心臓カテーテル検査では,下行大動脈からの造影でPDAはKrichenko A型(Fig. 4)に描出され,ampulla径3.5 mm, PA側2.2 mm,最狭部2.5 mm,長さ8.9 mmであった.Fick法を用いて計算したQp/Qsは1.0,肺血管抵抗値は1.08 Wood単位・m2であった.成人先天性心疾患診療ガイドライン4)に基づき,推奨クラスI,エビデンスレベルCと判断し,初回治療後34年目に再閉鎖目的で入院となった.
Table 1 Blood test results (Day 1 of hospitalization)| Complete blood cell counts | Serum chemistries |
|---|
| WBC | 9700 /mL | TP | 7.4 g/dL |
| Neut | 51.0% | Alb | 4.5 g/dL |
| Lym | 47.0% | T.Bil | 0.7 mg/dL |
| Mono | 2.0% | AST | 28 U/L |
| | ALT | 36 U/L |
| RBC | 476 ×104/µL | LDH | 206 U/L |
| Hgb | 14.3 g/dL | CPK | 86 U/L |
| Hct | 42.2% | BUN | 12.3 mg/dL |
| Plt | 34.4 ×104/µL | Cre | 0.74 mg/dL |
| Coagulation studies | Na | 141 mEq/L |
|---|
| PT | 10.8 sec | K | 4.3 mEq/L |
| PT-INR | 0.81 | Cl | 104 mEq/L |
| APTT | 26.8%sec | Ca | 9.5 mg/dL |
| Fib | 315 mg/dL | Mg | 2.3 mg/dL |
| D dimer | 0.9 µg/mL | CRP | 0.07 mg/dL |
| | NT proBNP | < 10 pg/mL |
| WBC, white blood cells; Lym, lymphocytes; Neu, neutrophils; Mono, monocytes; RBC, red blood cells; Hgb, hemoglobin; Hct, hematocrit; Plt, platelet; TP, total protein; Alb, albumin; T. Bil, total bilirubin; AST, aspartate transaminase; ALT, alanine transaminase; LDH, lactate dehydrogenase; CPK, creatine phosphokinase; BUN, blood urea nitrogen; Cre, creatinine; Na, sodium; K, potassium; Cl, chlorine; Ca, calcium; Mg, magnesium; CRP, C-reactive protein; NT proBNP, N-terminal pro-brain natriuretic peptide; PT, Prothrombin Time; PT-INR Prothrombin Time International Normalized Ratio; APTT, Activated Partial Thromboplastin Time; Fib, Fibrinogen. |
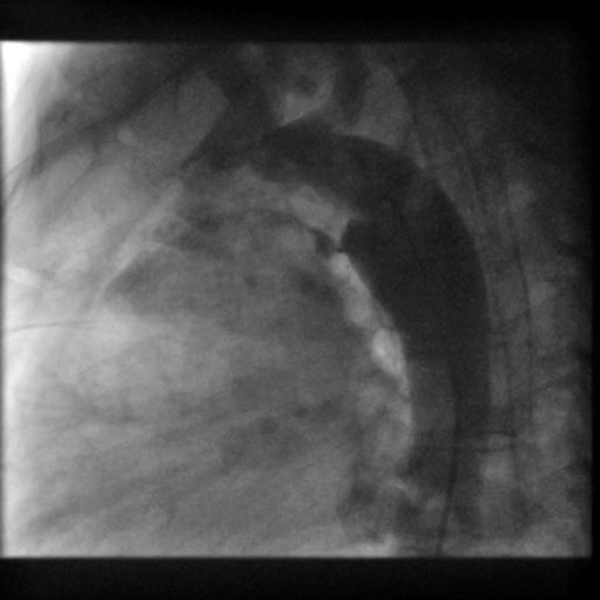
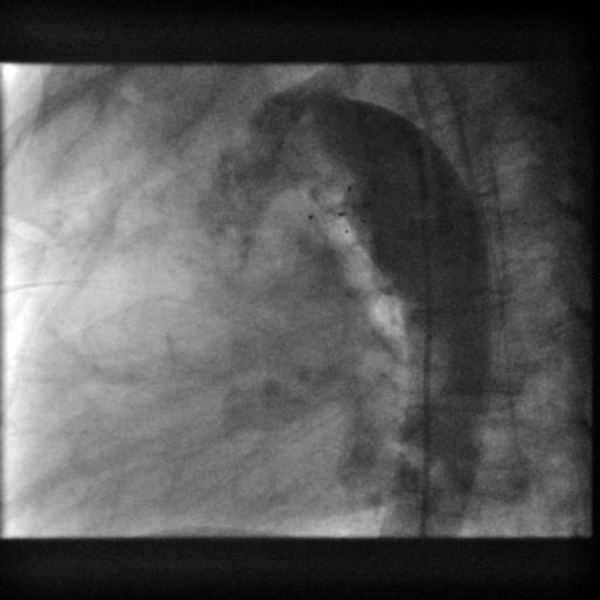
局所麻酔下で右大腿動静脈よりアプローチを行った.大動脈造影にて動脈管の形態とシャントの存在を確認し,グッドテックカテーテルJR40(Goodman Co., Ltd., Nagoya, Japan)と0.035インチRadifocus® Guide Wire M(Terumo Corporation, Tokyo, Japan)を使用してPDAを通過させた.Rashkindデバイスの位置を確認し,干渉を避けるよう慎重に4Fr TorqVue™ LP Delivery System sheath(Abbott Cardiovascular, MN, USA)を大動脈側から遺残短絡部に通過させた.肺動脈側の最狭部2.5 mm,全長8.9 mmの短絡であったため,サイジングチャートの推奨通りADOIIウエスト径4 mm長さ6.25 mm(品番:9-PDA2-04-06)を選択した.ADOIIを適切な位置に展開し,5分後の造影で確認したが残存シャントは認められなかった(Fig. 5).全手技時間は約45分,透視時間は12分であり,術中合併症はなく,術後経過も良好であった.術後2日目に退院した.
術後1か月目の心エコー検査では,動脈管の再開は認められず,LVEDDは57 mmから49 mmへと縮小していた.さらに6か月後の心エコーでもデバイス位置は安定していた.胸部レントゲンではCTRが47%から44%へ縮小していた.術後経過は良好である.
本症例は,乳児期にRashkind occlusion deviceでPDA閉鎖を行った後,成人期に残存シャントが増加し,ADOIIによる再閉鎖が成功した稀なケースである.小短絡のPDAでも,長期にわたる左室容量負荷が心機能に影響を与える可能性がある.Campbellは未治療PDAの自然経過で突然死のリスクを報告しており,症状の有無にかかわらず再評価が必要である5).
Rashkindデバイスは再配置が困難で,長期経過中に周囲組織との癒着や石灰化が生じることがある.また,国内臨床試験時の成績でも平均104か月後の完全閉鎖率は77%であり,ほかのデバイスによる閉鎖率より低い6).一方,ADOIIは柔軟で再配置可能な特性を持ち,短小なPDAや異形例にも対応可能である.ADOIIはdiskが大きく体格の小さい小児には使いにくいデバイスだが,両側diskで留置できる大きな体格のPDA治療後の遺残短絡には,中心部の変形度が高く対応可能であるため,カテーテルが通れば同病態に汎用性が高い.Shyuらが報告した「Device in Device」戦略は,既存デバイスを抜去せずに新たなデバイスを重ねて留置する方法であり,過去のデバイス治療歴がある患者にとって重要な技術的進歩である7).本症例でも,動脈管の遺残短絡部に0.035インチRadifocus® Guide Wire Mを通した後,グッドテックカテーテルJR40を進める際に抵抗がなかったため,ADOIIの4Fr TorqVue™ LP Delivery System sheathが通ると考え,coilによる閉鎖の選択肢を外した.治療前の造影からは肺動脈側とAmpula側に両側disk形態での留置を想定していたが,ADOIIのウエストが短絡部位に収まり,より閉塞に適した形態で留置できた.Rashkindデバイスとの干渉を最小限に抑えつつ,ADOIIを正確な位置に留置することができた.
PDA再開通の原因として,初回閉鎖時の不完全な閉鎖,デバイスの構造的劣化,血管壁の変性・拡張などが挙げられ,経カテーテル的閉鎖術後に残存シャントがあるPDAに対する介入の適応は,明確なガイドラインが存在しないが,2018年のAHA/ACCガイドライン8)では,左→右シャントにより左室容量負荷が示唆される場合にはClass IIaの適応があるとされている.本症例でもQp/Qsが1.2とシャントの存在が確認され,LVEDDの拡大と併せて介入の適応があると判断した.無症候例でも,長期的視点から心機能維持と心不全予防の観点で早期介入が推奨される.術後経過においても,デバイスの適切な留置とシャントの完全閉鎖が確認され,LVEDDの縮小傾向を認めた.これは左室の容量負荷の改善と心臓のリバースリモデリングを示唆する.Zhaoらの報告でも,ADOIIを用いたPDA閉鎖後に,本症例と同様に左室拡張末期径LVEDDの有意な減少が認められ,心機能保護的な側面が強調されている9).
乳児期にRashkind occlusion deviceによりPDA閉鎖を受けた症例において,成人期に残存シャントが認められ,ADOIIによる再閉鎖が良好な結果をもたらした.小短絡のPDAであっても左室拡大などの血行動態的変化がみられた場合には再評価と介入が必要であり,長期フォローアップの重要性が再認識される.
著者の役割
佐藤は筆頭著者として論文を執筆した.矢崎は共著者として論文構成,データ収集,分析に貢献した.嘉川は共著者として論文構成に貢献した.
引用文献References
1) Schneider DJ, Moore JW: Patent ductus arteriosus. Circulation 2006; 114: 1873–1882
2) Rashkind WJ, Mullins CE, Hellenbrand WE, et al: Nonoperative closure of patent ductus arteriosus in the new-born by transcatheter delivery of an occluding device. N Engl J Med 1979; 300: 1511–1512
3) Pass RH, Hijazi Z, Hsu DT, et al: Multicenter USA Amplatzer patent ductus arteriosus occlusion device trial: Initial and one-year results. J Am Coll Cardiol 2004; 44: 513–519
4) 山岸敬幸,石津智子,三谷義英,ほか.成人先天性心疾患診療ガイドライン(2025年改訂版).Circ J. 2025
5) Campbell M: Natural history of persistent ductus arteriosus. Heart 1968; 30: 4–13
6) 矢崎 諭,小野安生,新垣義夫,ほか:Rashkind閉鎖栓を使用した動脈管開存閉鎖術の長期予後.日小児循環器会誌2000; 16: 654-662
7) Shyu KG, Wu CC, Tseng CD, et al: Transcatheter closure of a recanalized PDA using a device-in-device technique: A case report. Catheter Cardiovasc Interv 2001; 54: 388–392
8) Stout KK, Daniels CJ, Aboulhosn JA, et al: 2018 AHA/ACC guideline for the management of adults with congenital heart disease: A report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2019; 73: 81–192
9) Zhao LJ, Han B, Zhang JJ, et al: Reverse remodeling of left ventricle after. transcatheter closure of PDA with ADO-II in adults. Catheter Cardiovasc Interv 2019; 94: 720–726